题目内容
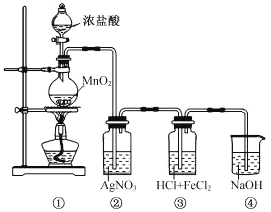
【题目】实验室常用![]() 与浓盐酸反应制备
与浓盐酸反应制备![]() 。
。
(1)制备反应会因盐酸浓度下降面停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量![]() 溶液反应,称量生成的
溶液反应,称量生成的![]() 质量。
质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与己知量![]() (过量)反应,称量剩余的
(过量)反应,称量剩余的![]() 质量。
质量。
丁方案:与足量![]() 反应,测量生成的
反应,测量生成的![]() 体积。
体积。
继而进行下列判断和实验:
①判定甲方案不可行。现由是_________。
②进行乙方案实验;准确量取残余清液稀释一定倍数后作为试样。
a.量取试样![]() ,用
,用![]() 标准溶液滴定,选择的指示剂是____,消耗
标准溶液滴定,选择的指示剂是____,消耗![]() ,该次滴定测得试样中盐酸浓度为_______
,该次滴定测得试样中盐酸浓度为_______![]()
b._________,获得实验结果。
③判断两方案的实验结果________(填“偏大”、“偏小”或“准确”).
[已知:![]() 、
、![]() ]
]
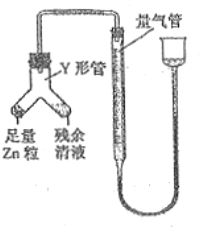
④进行丁方案实验:装置如图所示(夹持器具已略去)。
a.使Y形管中的残余清液与锌粒反应的正确操作是将_______转移到____中。
b.反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是__________(排除仪器和实验操作的影响因素),至体积不变时,量气管的左侧液面高于右侧液面,此时读数测得的体积__________(填“偏大”、“偏小”或“准确”)
(2)若没有酒精灯,也可以采用![]() 与浓盐酸反应制取适量氯气的如下简易装置。
与浓盐酸反应制取适量氯气的如下简易装置。
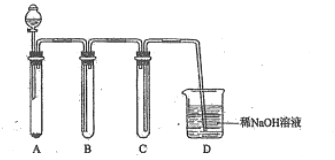
装置B、C、D的作用分别是:
B___________C______________D______________
【答案】残余液中的![]() 也会与
也会与![]() 反应形成沉淀 甲基橙 0.1100 重复上述滴定操作2-3次 偏小 锌粒 残余清液 装置内气体尚未冷却至室温 偏大 收集氯气 防倒吸 吸收尾气
反应形成沉淀 甲基橙 0.1100 重复上述滴定操作2-3次 偏小 锌粒 残余清液 装置内气体尚未冷却至室温 偏大 收集氯气 防倒吸 吸收尾气
【解析】
(1)①甲同学的方案:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,故反应不可行;
②用强碱滴定强酸,可选甲基橙作指示剂;依据滴定实验过程中的化学反应定量计算;重复滴定操作2-3次,求平均值;
③与已知量CaCO3(过量)反应,称量剩余的CaCO3质量,由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大;
④依据锌粒与稀盐酸反应生成氢气进行分析解答;使Zn粒进入残余清液中让其发生反应.这样残余清液就可以充分反应.
反应完毕时,相同时间内则气体体积减少,又排除了其它影响因素,只能从气体本身角度思考,联想到该反应是放热的,就可能想到气体未冷却了。
气体的体积与压强呈反比。
(2)A制取氯气 B用向上排空法收集氯气,C防倒吸 D 吸收尾气,防止污染空气。
(1)①甲同学的方案:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,故不能用来测定残余液中盐酸的质量,反应不可行;
②用强碱滴定强酸,可选甲基橙作指示剂;量取试样20.00mL,用0.1000mol·L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度,由cHClVHCl=cNaOHVNaOH可得出盐酸的浓度为0.1100mol·L-1;
③根据Ksp(CaCO3)=2.8×10-9,Ksp(MnCO3)=2.3×10-11知碳酸锰的Ksp比碳酸钙小,由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大,这样一来反应的固体减少,实验结果偏小,
④a.丁同学的方案:使Y形管中的残余清液与锌粒反应的正确操作是:将锌转移到残留溶液中;
b.反应完毕后,每间隔1分钟读取气体体积.气体体积逐渐减小,气体体积逐渐减小的原因是气体未冷却到室温,当温度冷却到室温后,气体体积不再改变;
量气管的左侧液面高于右侧液面,左侧气体的压强偏小,此时读数测得的体积偏大;
(2)根据装置图可知各装置的作用分别是A制取氯气,B用向上排空法收集氯气,C防倒吸, D 吸收尾气,防止污染空气。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案