题目内容
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是
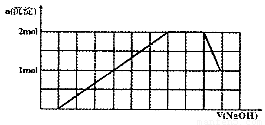
A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+?????????????
B.原溶液中一定含有SO42-和Na+
C.原溶液中SO42-的物质的量至少为4.5mol
D.反应最后形成的溶液中含有的溶质为Na2SO4
C
【解析】
试题分析:向该溶液中加入一定物质的量浓度的NaOH溶液时,开始无沉淀,说明溶液中含有H+离子,由于2H++CO32-=H2O+CO2↑,所以不含有CO32-;随着NaOH的加入,沉淀越来越多,当沉淀达到最大值时,沉淀的质量不再变化,说明发生反应NH4++OH-=NH3·H2O 。则含有NH4+;再继续加入沉淀又有所减少,说明含有Al3+,则根据图像可知n(Al3+)=1mol,产生沉淀Al(OH)3沉淀消耗NaOH的物质的量为3mol,使Al(OH)3沉淀溶解消耗NaOH为1mol,由图可看出1mol的NaOH占有的体积为1个格。在溶液中发生反应:Al3++3OH-=Al(OH)3↓; Al(OH)3 +OH-=AlO2-+2H2O.由于沉淀未完全溶解,说明还含有难溶性物质。该沉淀为1mol,产生该沉淀消耗NaOH为3mol,是Fe(OH)3则原溶液含有n(H+)=1mol; n(NH4+)=2mol;n(Al3+)=1mol;n(Fe3+)=1mol.????????????? 根据溶液的电中性原理,则一定还含有SO42-。若原溶液中不含有Na+,则2n(SO42-)= n(H+)+ n(NH4+)+ 3n(Al3+)+3 n(Fe3+).=1+2+3×1+3×1=9mol, n(SO42-)=4. 5mol;若原溶液中含有Na+,则阴离子SO42-的物质的量还要增多。因此原溶液中SO42-的物质的量至少为4.5mol.由上述分析可知:反应到最后一定含有的物质为Na2SO4及NaAlO2。
考点:考查图像法在物质的鉴定中既含量的测定中的应用的知识。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案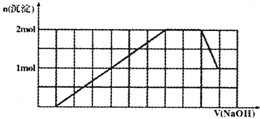 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )| A、原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ | B、原溶液中一定含有SO42-和Na+ | C、原溶液中SO42-的物质的量至少为3.5mol | D、反应最后形成的溶液中含有的溶质为Na2SO4 |
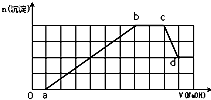 某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )| A、d点溶液中含有的溶质只有Na2SO4 | B、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 | C、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ | D、原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种 |
 (2012?上饶二模)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
(2012?上饶二模)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( ) 某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,由此可知
某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,由此可知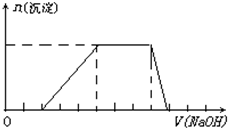 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液体积的变化如图所示,由此可知,该溶液中一定含有的阳离子是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液体积的变化如图所示,由此可知,该溶液中一定含有的阳离子是