题目内容
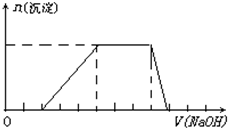 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液体积的变化如图所示,由此可知,该溶液中一定含有的阳离子是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液体积的变化如图所示,由此可知,该溶液中一定含有的阳离子是分析:开始加入NaOH没有沉淀和气体产生,则一定有H+,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3?H2O的反应,则有NH4+,根据离子反应发生的条件进行判断及用相关化学方程式进行计算.
解答:解:从图象可知,开始时无沉淀产生,说明含有H+,H++OH-=H2O,该氢离子消耗NaOH溶液的体积为2体积,图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3?H2O,铵根消耗氢氧化钠为3体积,最后溶液中无沉淀,说明溶液中不含Mg2+和Fe3+,含有Al3+,根据Al3++3 OH-=Al(OH)3↓,铝离子消耗NaOH溶液的体积为3体积,当消耗4体积的氢氧化钠时沉淀消失,所以可得到H+、Al3+、NH4+的物质的量之比为2:1:3.
故答案为:H+、Al3+、NH4+;2:1:3;Mg2+、Fe3+.
故答案为:H+、Al3+、NH4+;2:1:3;Mg2+、Fe3+.
点评:本题考查离子的判断和计算,题目难度中等,要求学生熟记物质的性质并灵活应用.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
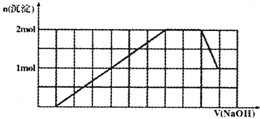 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )| A、原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ | B、原溶液中一定含有SO42-和Na+ | C、原溶液中SO42-的物质的量至少为3.5mol | D、反应最后形成的溶液中含有的溶质为Na2SO4 |
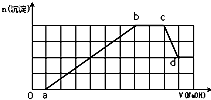 某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )| A、d点溶液中含有的溶质只有Na2SO4 | B、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 | C、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ | D、原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种 |
 (2012?上饶二模)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
(2012?上饶二模)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( ) 某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,由此可知
某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,由此可知