题目内容
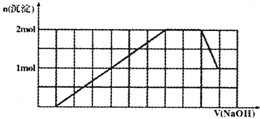 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )| A、原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ | B、原溶液中一定含有SO42-和Na+ | C、原溶液中SO42-的物质的量至少为3.5mol | D、反应最后形成的溶液中含有的溶质为Na2SO4 |
分析:A、根据生成沉淀的物质的量随NaOH溶液的体积变化的图象来确定存在的离子;
B、根据电荷守恒结合A选项的内容来确定存在的离子;
C、根据消耗氢氧化钠的量和生成沉淀的量来确定离子的物质的量的多少;
D、根据溶液中离子之间的反应来确定含有的溶质.
B、根据电荷守恒结合A选项的内容来确定存在的离子;
C、根据消耗氢氧化钠的量和生成沉淀的量来确定离子的物质的量的多少;
D、根据溶液中离子之间的反应来确定含有的溶质.
解答:解:A、根据图象第一段,沉淀不是马上出现,可知一定有氢离子,酸碱中和反应是一切反应的优先反应,生成沉淀在后面溶解一部分,一定有铝离子,根据第三段,和氢氧化钠反应的离子不产生沉淀,证明是铵根离子,根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,所以形成氢氧化铝用了三体积的氢氧化钠,还有三体积的氢氧化钠可能被三价铁离子消耗,也可能被镁离子消耗,所以不能确定是铁离子还是镁离子,即原溶液中含有的阳离子一定有H+、
NH4+、Al3+,故A错误;
B、根据A的推断,一定含有的阳离子是H+、NH4+、Al3+,一定不含碳酸根离子,溶液中需要正、负离子,故一定有阴离子SO42-,不能确定钠离子是否存在,故B错误;
C、根据坐标得氢氧化铝溶解用了1体积的氢氧化钠,而氢氧化铝的物质的量为1mol,故1体积氢氧化钠含氢氧化钠的物质的量为1mol,沉淀达到最大量共消耗7体积氢氧化钠,即消耗7mol氢氧化钠,此时溶液中溶质为硫酸钠,根据钠守恒,硫酸钠的物质的量为3.5mol,因不确定原溶液是否存在钠离子,原溶液中SO42-的物质的量至少为3.5mol,故C正确;
D、根据溶液中的离子的存在情况可知道,最后溶液中含有的溶质除了Na2SO4,还有偏铝酸钠,故D错误.
故选C.
NH4+、Al3+,故A错误;
B、根据A的推断,一定含有的阳离子是H+、NH4+、Al3+,一定不含碳酸根离子,溶液中需要正、负离子,故一定有阴离子SO42-,不能确定钠离子是否存在,故B错误;
C、根据坐标得氢氧化铝溶解用了1体积的氢氧化钠,而氢氧化铝的物质的量为1mol,故1体积氢氧化钠含氢氧化钠的物质的量为1mol,沉淀达到最大量共消耗7体积氢氧化钠,即消耗7mol氢氧化钠,此时溶液中溶质为硫酸钠,根据钠守恒,硫酸钠的物质的量为3.5mol,因不确定原溶液是否存在钠离子,原溶液中SO42-的物质的量至少为3.5mol,故C正确;
D、根据溶液中的离子的存在情况可知道,最后溶液中含有的溶质除了Na2SO4,还有偏铝酸钠,故D错误.
故选C.
点评:本题是一道有关离子检验的综合知识题目,考查角度很广,难度较大.氢氧化铝是两性氢氧化物溶于强碱是解题关键.

练习册系列答案
相关题目
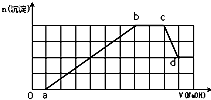 某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )| A、d点溶液中含有的溶质只有Na2SO4 | B、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 | C、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ | D、原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种 |
 (2012?上饶二模)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
(2012?上饶二模)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( ) 某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,由此可知
某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,由此可知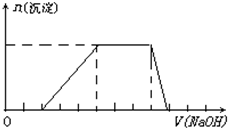 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液体积的变化如图所示,由此可知,该溶液中一定含有的阳离子是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液体积的变化如图所示,由此可知,该溶液中一定含有的阳离子是