题目内容
14.用元素符号回答下列问题:在第三周期元素中(不包括稀有气体元素),原子半径最大的金属元素是Na,原子半径最小的非金属元素是Cl;单质还原性最强的元素是Na;最高价氧化物对应的水化物碱性最强的元素是Na;气态氢化物最稳定的元素是Cl.分析 同周期元素从左到右原子半径逐渐减小,元素的金属性逐渐减弱,非金属性逐渐增强,以此判断对应的单质、化合物的相关性质.
解答 解:同周期元素从左到右原子半径逐渐减小,则在第三周期元素中(不包括稀有气体元素),原子半径最大的金属元素是Na,原子半径最小的非金属元素是Cl;金属性最强的为Na,则单质还原性最强的元素是Na,最高价氧化物对应的水化物碱性最强的元素是Na;非金属性最强的为Cl,则气态氢化物最稳定的元素是Cl,
故答案为:Na;Cl;Na;Na;Cl.
点评 本题考查元素周期表和元素周期律,为高频考点,把握同周期元素的性质及递变规律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
5.下列各组粒子能在指定溶液中大量共存的是( )
| A. | 银氨溶液中:Na+,H+,NO3- | B. | 碘化钾溶液中:H+,H2O,SO32- | ||
| C. | 偏铝酸钠溶液中:K+,Cl-,SO42- | D. | 氢氧化钙溶液中:Na+,ClO-,HCO3- |
2.提出了核外电子分层排布的原子结构模型的科学家是( )
| A. | 卢瑟福 | B. | 玻尔 | C. | 汤姆逊 | D. | 道尔顿 |
19.用惰性电极电解下列溶液一段时间后,再加入一定量的某种物质(括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
| A. | AgNO3(AgNO3) | B. | NaOH(NaOH) | C. | KCl(KCl) | D. | CuSO4(CuO) |
6.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色.
(1)B元素在元素周期表中的位置第三周期第ⅢA族B形成的简单离子的结构示意图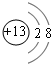 .
.
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是H2SO4.
(3)用电子式表示C、H形成化合物的过程: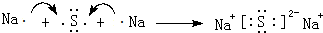 .
.
(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键和非极性键.
(5)G的最高价与E形成的化合物的电子式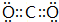 ,该分子的结构式为O=C=O.
,该分子的结构式为O=C=O.
(6)A、B、C、E原子半径由大到小的顺序为Mg>Al>S>O.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置第三周期第ⅢA族B形成的简单离子的结构示意图
 .
.(2)上述元素的最高价氧化物对应的水化物中酸性最强的是H2SO4.
(3)用电子式表示C、H形成化合物的过程:
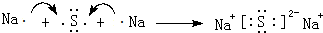 .
.(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键和非极性键.
(5)G的最高价与E形成的化合物的电子式
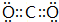 ,该分子的结构式为O=C=O.
,该分子的结构式为O=C=O.(6)A、B、C、E原子半径由大到小的顺序为Mg>Al>S>O.
3.下列属于天然高分子化合物的是( )
| A. | 聚乙烯 | B. | 硝化纤维 | C. | 淀粉 | D. | 油脂 |
 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题: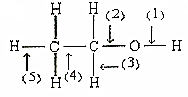 根据如图所示的乙醇分子结构判定在以下反应中分子中化学键的断裂情况.
根据如图所示的乙醇分子结构判定在以下反应中分子中化学键的断裂情况.