题目内容
9.工业上制备氯酸钾的方法是:向热的石灰乳中通入氯气,用结晶法除去氯化钙后再加入一种钠盐,合适的钠盐是Na2CO3.分析 石灰乳与氯气反应生成氯化钙和氯酸钙,除去氯化钙后,可加入碳酸钠溶液,以生成碳酸钙沉淀,以此得到氯酸钠,以此解答该题.
解答 解:热的石灰乳通入氯气,反应的方程式为:2Cl2+2Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+Ca(ClO)2+2H2O,除去CaCl2后主要成分为Ca(ClO)2,要加入钠盐得到NaClO3,应加入Na2CO3,发生复分解反应生成碳酸钙沉淀,故答案为:Na2CO3.
点评 本题以氯酸盐的制备为载体考查物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质,为解答该题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列说法正确的是( )
| A. | 金属元素和非金属元素间形成的化学键一定是离子键 | |
| B. | 伴有能量变化的物质变化不一定是化学变化 | |
| C. | 可逆反应达到化学平衡时,正逆反应速率都为0 | |
| D. | 通过化学变化可以实现1H与2H间的相互转化 |
20.“塑料袋--想说爱你不容易!”自1902年10月24日奥地利科学家马克斯•舒施尼发明它以来,也只有短短的一百多年时间.这些花花绿绿、大大小小的塑料袋,不仅破坏城市景观,对环境的危害也是极惊人的.2008年6月1日起,根据国务院要求,所有超市、商场、集贸市场等商品零售场所实行塑料购物袋有偿使用.下列说法正确的是( )
| A. | 聚丙烯塑料的结构简式为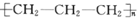 | |
| B. | 聚氯乙烯塑料单体的电子式为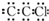 | |
| C. | 塑料购物袋的生产原料需要消耗大量木材 | |
| D. | 聚乙烯中含碳质量分数与其单体的含碳质量分数相同 |
18.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
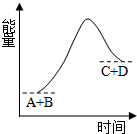

| A. | 形成C、D键释放的总能量大于断A、B键吸收的总能量 | |
| B. | 此反应反应物的总能量高于生成物的总能量 | |
| C. | 此反应为一个吸热的反应 | |
| D. | 此反应只有在加热条件下才能进行 |
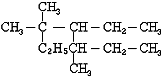 完成下列小题
完成下列小题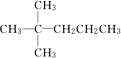 ,
,