题目内容
2.提出了核外电子分层排布的原子结构模型的科学家是( )| A. | 卢瑟福 | B. | 玻尔 | C. | 汤姆逊 | D. | 道尔顿 |
分析 A.卢瑟福(汤姆逊的学生)提出了带核的原子结构模型;
B.波尔引入量子论观点,提出电子在一定轨道上运动的原子结构模型;
C.汤姆逊发现了电子,提出“葡萄干面包式”的原子结构模型;
D.道尔顿提出了近代原子学说.
解答 解:A.卢瑟福(汤姆逊的学生)提出了带核的原子结构模型,故A错误;
B.波尔引入量子论观点,提出电子在一定轨道上运动的原子结构模型,故B错正确;
C.汤姆逊发现了电子,提出“葡萄干面包式”的原子结构模型,故C错误;
D.道尔顿提出了近代原子学说,故D错误.
故选B.
点评 本题主要考查了化学史,难度不大,平时注意知识的积累.

练习册系列答案
相关题目
12. 运动员服用兴奋剂是违背人文道德的.某种兴奋剂的结构简式如下图所示,有关该物质的说法错误的是( )
运动员服用兴奋剂是违背人文道德的.某种兴奋剂的结构简式如下图所示,有关该物质的说法错误的是( )
 运动员服用兴奋剂是违背人文道德的.某种兴奋剂的结构简式如下图所示,有关该物质的说法错误的是( )
运动员服用兴奋剂是违背人文道德的.某种兴奋剂的结构简式如下图所示,有关该物质的说法错误的是( )| A. | 滴入KMnO4(H+)溶液,观察到紫色褪去 | |
| B. | 该分子中的所有碳原子可能共平面 | |
| C. | 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol | |
| D. | 遇FeCl3溶液不显颜色 |
10.草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
[查阅资料]KMnO4溶液氧化H2C2O4的反应历程为:
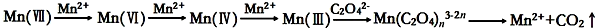
[提出假设]
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是反应物浓度降低,反应速率减慢.
[设计、完成实验]
(1)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL0.10mol/L H2C2O4溶液.
①在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶.
②下列操作会使所配溶液浓度偏低的是AD(填下列选项的字母序号).
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
x=25时,假设2成立.
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定.取10.00mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.上述实验中KMnO4溶液的物质的量浓度为0.010mol/L.
[查阅资料]KMnO4溶液氧化H2C2O4的反应历程为:
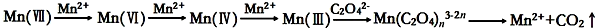
[提出假设]
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是反应物浓度降低,反应速率减慢.
[设计、完成实验]
(1)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL0.10mol/L H2C2O4溶液.
①在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶.
②下列操作会使所配溶液浓度偏低的是AD(填下列选项的字母序号).
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
| 实验编号 | 烧杯中所加试剂及用量(mL) | 控制 条件 | 溶液褪色时间(S) | |||
| 0.10mol/LH2C2O4 溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65° | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5mL0.10mol/LK2SO4 | 18 |
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定.取10.00mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.上述实验中KMnO4溶液的物质的量浓度为0.010mol/L.
7.放射性元素钚(Pu)有20种放射性同位素,下列关于${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu的说法正确的是( )
| A. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu都含有94个中子 | |
| B. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu互为同位素 | |
| C. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu的核外电子数不同 | |
| D. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu分别含有146和147个质子 |
11.下列措施可以降低化学反应速率的是( )
| A. | 生活中,用冰箱保存食物 | |
| B. | H2O2分解时,用MnO2 作催化剂 | |
| C. | 工业合成氨时,采用高温高压的措施 | |
| D. | 提高反应物的浓度 |
12.最近科学界合成一种“二重结构”的球形物质分子,是把足球型的C60分子融进足球型的Si60分子中,外面的Si原子与里面的C原子结合,下列关于这种物质的叙述中正确的是( )
| A. | 是两种单质的混合物 | B. | 是共价化合物 | ||
| C. | 该新物质硬度很大 | D. | 含有离子键 |