题目内容
4. 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:(1)曲线由O→a段不产生氢气的原因( 请用有关反应的化学方程式表示)是2Al+3H2SO4=Al2(SO4)3+3H2↑.
(2)曲线a→c段,产生氢气的速率增加较快,而曲线由c以后,产生氢气的速率逐渐下降,解释上述现象的原因是该反应放热,c点前温度对反应速率的影响大于浓度对反应速率的影响,c点后浓度对反应速率的影响较大
(3)在b到c这段时间内,收集到氢气VL(标准状况),则这段时间内用硫酸表示的平均速率为$\frac{V}{11.2(b-c)}$(假设反应前后溶液体积不变).
(4)对于足量镁条和100ml 2mol/L硫酸生成氢气的反应,下列措施能减缓反应速率,但又不影响生成氢气的总量的是②③④⑧.
①加NaOH固体;②加适量BaCl2溶液;③加KNO3溶液;④加适量H2O;
⑤将镁条换成镁粉;⑥加小苏打溶液;⑦加少量CuSO4溶液;
⑧加适量Na2SO4溶液;⑨将2mol/L硫酸换成160mL 2.5mol/L的盐酸;
(5)若使用催化剂,会不会使氢气的产量增加?不会(填“会”或“不会”).
分析 (1)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成氧化铝,根据氧化铝的性质分析;
(2)金属和酸的反应是放热反应,温度升高是影响反应速率的主要因素,根据温度对化学反应速率的影响分析,溶液的浓度是影响化学反应速率的主要因素;
(3)据化学方程式可知,硫酸与氢气化学计量数相同,v(H2SO4)=v(H2),据此分析;
(4)减缓反应速率,可降低浓度、温度,不影响生成氢气的总量,则氢离子的物质的量不变,以此解答;
(5)催化剂加快反应速率,不影响氢气的产量.
解答 解:(1)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成氧化铝,氧化铝首先稀硫酸反应生成氯化铝和水,不产生H2,化学方程式为2Al+3H2SO4=Al2(SO4)3+3H2↑故答案为:2Al+3H2SO4=Al2(SO4)3+3H2↑;
(2)金属和酸的反应是放热反应,使溶液的温度升高,温度升高是影响反应速率的主要因素,化学反应速率加快,随着反应的进行,溶液中的氢离子浓度逐渐降低,氢离子浓度是影响化学反应速率的主要因素,所以反应速率逐渐减小,
故答案为:该反应放热,c点前温度对反应速率的影响大于浓度对反应速率的影响,c点后浓度对反应速率的影响较大;
(3)据化学方程式可知,硫酸与氢气化学计量数相同,v(H2SO4)=v(H2)=$\frac{V}{11.2(b-c)}$,故答案为:$\frac{V}{11.2(b-c)}$;
(4)减缓反应速率,可降低浓度、温度,不影响生成氢气的总量,则氢离子的物质的量不变,①加NaOH固体能够反应氢离子,氢离子物质的量减少;②加适量BaCl2溶液相当于加水稀释;③加KNO3溶液,生成硝酸,不生成氢气;④加适量H2O,氢离子浓度减小;⑤将镁条换成镁粉,加快反应速率;⑥加小苏打溶液,能够反应氢离子,氢离子物质的量减少;⑦加少量CuSO4溶液,形成原电池,反应速率加快;则符合要求的有②③④⑧,
故答案为:②③④⑧;
(5)催化剂加快反应速率,不影响氢气的产量,
故答案为:不会.
点评 本题考查了化学反应速率的影响因素以及反应速率的计算,难度不大,注意根据图象分析理解随反应进行影响反应速率的主导元素.

| A. | “四中子”不显电性 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “零号元素”在元素周期表中与氢元素占同一位置 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
 分子中,处于同一平面上的碳原子数最多可能有( )
分子中,处于同一平面上的碳原子数最多可能有( )| A. | 6个 | B. | 8个 | C. | 10个 | D. | 12个 |
 运动员服用兴奋剂是违背人文道德的.某种兴奋剂的结构简式如下图所示,有关该物质的说法错误的是( )
运动员服用兴奋剂是违背人文道德的.某种兴奋剂的结构简式如下图所示,有关该物质的说法错误的是( )| A. | 滴入KMnO4(H+)溶液,观察到紫色褪去 | |
| B. | 该分子中的所有碳原子可能共平面 | |
| C. | 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol | |
| D. | 遇FeCl3溶液不显颜色 |
| A. | 金属元素和非金属元素间形成的化学键一定是离子键 | |
| B. | 伴有能量变化的物质变化不一定是化学变化 | |
| C. | 可逆反应达到化学平衡时,正逆反应速率都为0 | |
| D. | 通过化学变化可以实现1H与2H间的相互转化 |
| A. | 分子式是C3H8O3 | |
| B. | A催化氧化的产物能发生银镜反应 | |
| C. | 0.1 mol A与足量Na反应产生2.24 L H2(标准状况) | |
| D. | A在一定条件下发生缩聚反应的产物是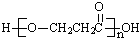 |
| A. | C3H8 | B. | C2H6 | C. | CH4 | D. | C4H8 |