题目内容
25℃时下列叙述正确的是
| A.0.10mol·L-1的三种溶液:①NaCl、②NaOH、③CH3COONa,其pH大小顺序为:③>②>① |
| B.0.10mol·L-1NaHCO3溶液中:c(CO32-)+c(HCO3-)+c(H2CO3)=0.10mol·L-1 |
| C.pH=2的盐酸和pH=12的NaOH溶液中,水的离子积Kw相同 |
| D.与体积相同、pH=2的盐酸和醋酸完全反应,需要0.010mol·L-1 NaOH的体积相同 |
BC
解析试题分析:①②③分别是强酸强碱盐、强碱、强碱弱酸盐溶液,因此分别显中性、强碱性、弱碱性,因此等温等浓度溶液的pH:②>③>①,故A错误;根据盐溶液中的物料守恒原理可知,c(CO32-)+c(HCO3-)+c(H2CO3)=c(Na+),由于碳酸氢钠是完全电离的强电解质,NaHCO3=Na++HCO3-,则c(Na+)=c(NaHCO3)=0.10mol·L-1,故B正确;水的离子积Kw只与温度有关,与氢离子或氢氧根离子浓度改编引起的平衡移动无关,温度相同Kw相等,故C正确;pH=2,则c(H+)=0.01mol·L-1,由于氯化氢是完全电离的强电解质,醋酸是部分电离的弱电解质,则c(HCl)= 0.01mol·L-1<<c(CH3COOH),由于n=c?V,则物质的量:HCl<<c(CH3COOH),因此醋酸消耗的氢氧化钠溶液的体积远远大于盐酸,故D错误。
考点:考查强电解质、弱电解质、水的离子积、溶液的pH、盐类水解、盐溶液中的物料守恒原理等。

常温时,下列叙述正确的是
| A.稀释pH=10的氨水,溶液中所有离子的浓度均降低 |
| B.pH均为5的HCl和NH4Cl溶液中,水的电离程度相同 |
| C.NaOH和CH3COONa的混合溶液中,c(Na+)+c(H+)═c(OH-)+c(CH3COO-) |
| D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
室温时,向20mL 0.1mol·L-1的醋酸溶液中不断滴人0.1mol·L-1的NaOH溶液,溶液的pH变化曲线如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
| A.a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -) |
| B.b点时:c( Na+) ="c(" CH3COO-)>c(H+)="c(" OH-) |
| C.c点时:c(H+)=c(CH3COOH) +c( OH-) |
| D.d点时:c(Na+)>c(CH3COO -)>c(OH-)>c(H+) |
25℃时,某氯化铵溶液pH=4,下列说法正确的是
| A.c(OH¯)=1×10¯10mol·L¯1 |
| B.c(NH4+)>c(Cl¯)>c(H+)>c(OH¯) |
| C.c(NH3·H2O)=c(NH4+) |
| D.c(H+)+c(NH4+)=c(Cl¯)+ c(OH¯) |
常温下,有下列四种溶液:
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
下列说法正确的是
A.由水电离出的c(H+):③>①
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH)
D.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COOˉ)>c(H+)>c(Na+)>c(OHˉ)
常温时,V1mL c1 mol/L的醋酸滴加到V2 mL c2 mol/L的烧碱溶液中,下列结论正确的是
| A.若V1=V2且混合溶液pH<7,则有c1>c2 |
| B.若c1V1= c2V2,则混合溶液中c(Na+)= c(CH3COO-) |
| C.若混合溶液的pH=7,则有c1V1>c2V2 |
| D.若混合溶液的pH=7,则混合溶液中c(Na+)>c(CH3COO-) |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的难溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于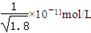 |
下列叙述正确的是
| A.相同温度下,中和pH=1的盐酸和醋酸各20.0mL,需要0.100 mol·L-1NaOH都是20.0mL |
| B.0.1mol·L-1Na2CO3中加入少量NaOH固体后振荡,c(Na+)和c(CO32-)都增大 |
| C.常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 |
| D.相同浓度的CH3COOH和 CH3COONa溶液等体积混合后,则:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
常温下,下列各组比值为1∶2的是
| A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比 |
| B.0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比 |
| C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 |
| D.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比 |