题目内容
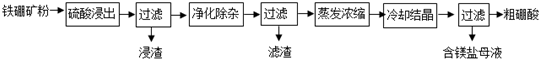
1. 一块表面被氧化的铝分成两等分,若向其中一份中滴加1mol•L-1的NaOH溶液,向另一份中滴加x mol•L-1的稀盐酸,产生氢气的物质的量与所加NaOH溶液、稀盐酸的体积关系如图所示.下列说法不正确的是( )
一块表面被氧化的铝分成两等分,若向其中一份中滴加1mol•L-1的NaOH溶液,向另一份中滴加x mol•L-1的稀盐酸,产生氢气的物质的量与所加NaOH溶液、稀盐酸的体积关系如图所示.下列说法不正确的是( )| A. | 该铝块的总质量为8.46g | |
| B. | a=260 | |
| C. | b=780 | |
| D. | 该铝块中氧化铝与铝单质的物质的量之比为3:20 |
分析 向其中一份中滴加1mol•L-1的NaOH溶液,铝样品表面的氧化铝先与氢氧化钠溶液反应生成偏铝酸钠,根据图示可知溶解氧化铝消耗了60mL 1mol/LNaOH溶液,则生成偏铝酸钠的物质的量为L1mol/L×0.06L=0.06mol,根据铝元素守恒可知氧化铝的物质的量为0.03mol,每份样品中氧化铝的质量为:102g/mol×0.03mol=3.06g;
样品中铝与氢氧化钠、盐酸反应生成氢气的物质的量为0.3mol,根据电子守恒可知铝的物质的量为:$\frac{0.3mol×2}{3}$=0.2mol,每份样品中Al的质量为:27g/mol×0.2mol=5.4g;则每份样品的质量为:3.06g+5.4g=8.46g,该铝块的总质量为:8.46g×2=16.92g;
0.03mol氧化铝与盐酸反应生成氯化铝,则溶解样品中的氧化铝消耗的HCl的物质的量为:0.03mol×3=0.09mol,则该盐酸的浓度为:x=$\frac{0.09mol}{0.18L}$=0.5mol/L;生成0.3mol氢气消耗HCl的物质的量为0.6mol,消耗该盐酸的体积为:$\frac{0.6mol}{0.5mol/L}$=1.2L,则a=1.2L+180mL=2L;
a点时所有Al元素都恰好转化成偏铝酸钠,则a点时偏铝酸钠的物质的量为:0.06mol+0.2mol=0.26mol,则消耗氢氧化钠溶液体积为:$\frac{0.26mol}{1mol/L}$=0.26L=260mL,据此进行判断.
解答 解:向其中一份中滴加1mol•L-1的NaOH溶液,铝样品表面的氧化铝先与氢氧化钠溶液反应生成偏铝酸钠,根据图示可知溶解氧化铝消耗了60mL 1mol/LNaOH溶液,则生成偏铝酸钠的物质的量为L1mol/L×0.06L=0.06mol,根据铝元素守恒可知氧化铝的物质的量为0.03mol,每份样品中氧化铝的质量为:102g/mol×0.03mol=3.06g;
样品中铝与氢氧化钠、盐酸反应生成氢气的物质的量为0.3mol,根据电子守恒可知铝的物质的量为:$\frac{0.3mol×2}{3}$=0.2mol,每份样品中Al的质量为:27g/mol×0.2mol=5.4g;
A.每份样品的质量为:3.06g+5.4g=8.46g,该铝块的总质量为:8.46g×2=16.92g,故A错误;
B.点时所有Al元素都恰好转化成偏铝酸钠,则a点时偏铝酸钠的物质的量为:0.06mol+0.2mol=0.26mol,则消耗氢氧化钠溶液体积为:$\frac{0.26mol}{1mol/L}$=0.26L=260mL,则a=260,故B正确;
C.0.03mol氧化铝与盐酸反应生成氯化铝,则溶解样品中的氧化铝消耗的HCl的物质的量为:0.03mol×3=0.09mol,则该盐酸的浓度为:x=$\frac{0.09mol}{0.18L}$=0.5mol/L;生成0.3mol氢气消耗HCl的物质的量为0.6mol,消耗该盐酸的体积为:$\frac{0.6mol}{0.5mol/L}$=1.2L,则b=1.2L+180mL=1.38L,故C错误;
D.样品中氧化铝与铝的物质的量之比为:0.03mol:0.2mol=3:20,故D正确;
故选AC.
点评 本题考查了离子反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握铝、氧化铝的化学性质,试题侧重考查学生的分析能力及化学计算能力.

| Y | Z | ||
| M | X |
| A. | 原子半径Z<M | |
| B. | 非金属性:X<Z | |
| C. | M元素最高价氧化物对应水化物具有两性 | |
| D. | Y的最高价氧化物对应水化物的酸性比X的弱 |
| A. | 溶液的质量增大 | B. | 溶质的溶解度增大 | ||
| C. | 溶液的浓度不变 | D. | 固体的质量一定不变 |
| A. | 乙烯 | B. | 丙烯 | C. | 丁烯 | D. | 任何烯烃 |
 化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.
化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.