题目内容
在容积不变的密闭容器中加入1 mol N2和3 mol H2发生反应,下列叙述正确的是
A.该反应的热化学方程式为:N2 + 3H2 2NH3ΔH =-92 kJ/mol 2NH3ΔH =-92 kJ/mol |
| B.达到平衡后向容器中通入1 mol氦气,平衡不移动 |
| C.曲线b表示可能使用了催化剂 |
| D.降低温度和缩小容器体积均可使该反应平衡常数增大 |
BC
解析试题分析:A、热化学方程式中应该在反应物与生成物的后边标明物质的聚集状态,错误;B、达到平衡后向容器中通入1 mol氦气,因为体积是固定的,不影响各种物质的浓度,因此各种物质的速率不变,从而平衡不移动,正确;C、正确;D、该平衡正向是一个放热反应,降低温度时,平衡正向移动,增大了平衡常数,缩小体积时,因为温度不变,因而平衡常数不变,错误。
考点:考查热化学方程式与平衡常数。

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
下列表述与示意图相符的是
| A.正反应为吸热反应 |
| B.升高温度,有利于反应向正方向进行 |
| C.A点时,反应向逆反应方向移动 |
| D.K正与K逆的关系是:K正=1/K逆 |
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) →PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50 s内的平均速率v(PCl3)=0.0032 mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,该反应为放热反应
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入 2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
C+CO2 2CO △H 1>0,反应速率v1 ,N2+3H2
2CO △H 1>0,反应速率v1 ,N2+3H2 2NH3 △H 2<0,反应速率v2 。若升高温度,v1和v2的变化是
2NH3 △H 2<0,反应速率v2 。若升高温度,v1和v2的变化是
| A.同时增大 | B.同时减少 | C.v1增大,v2减少 | D.v1减少,v2增大 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体 ②KNO3溶液 ③硫酸钾溶液 ④CH3COONa固体
| A.①③ | B.③④ | C.②③ | D.②④ |
判断一个化学反应的自发性常用焓判据和熵判据,则在下列情况下,可以判定反应一定自发进行的是
| A.ΔH>0,ΔS>0 | B.ΔH<0,ΔS>0 | C.ΔH>0,ΔS<0 | D.ΔH<0,ΔS<0 |
在密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是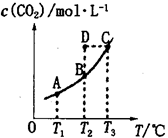
| A.平衡状态A与C相比,平衡状态A的c(CO)小 |
| B.在T2时,若反应处于状态D,则一定有v正<v逆 |
C.反应CO(g)+H2O(g) CO2(g)+H2(g)△H>0 CO2(g)+H2(g)△H>0 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
 xC(g) △H < 0,B、C的物质的量随时间变化的关系如图所示。下列有关说法不正确的是
xC(g) △H < 0,B、C的物质的量随时间变化的关系如图所示。下列有关说法不正确的是

