��Ŀ����
��14�֣��Ҵ�����Ҫ�Ļ���ԭ�Ϻ�Һ��ȼ�ϣ�������һ������������CO2��H2��Ӧ�Ƶã�
��ش�
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
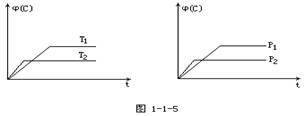
��2�����¶�T1>T2ʱ����ѧƽ�ⳣ��K1 K2���>������<����=������
��3���ں��¡����ݵ��ܱ������У�����������˵��������Ӧ�Ѵﻯѧƽ��״̬���� ������ĸ��ţ���
a������1molCH3CH2OH��ͬʱ����3 mol H2O
b�������и����Ũ�Ȳ���ʱ����仯
c�������л��������ܶȲ���ʱ����仯
d������������ķ�����������ʱ����仯
��4���ڹ�ҵ�����У���ʹH2��ת���ʺͻ�ѧ��Ӧ����ͬʱ��ߵĴ�ʩ�� ��д��һ��������ʩ���ɣ���
��5����ҵ�ϣ������Ҵ�Ϊԭ��������ȩ��������ͼ��ʾ��Ϣ���÷�Ӧ�� ��Ӧ������ȡ������ȡ������ж�������__________________��
��6���Ҵ�������Ϊȼ�ϵ�ص�ȼ�ϡ�ij�Ҵ�ȼ�ϵ�����Ҵ�Ϊȼ�ϣ�ʹ�����Ե���ʣ��õ�ظ�����Ӧ�ĵ缫��ӦʽΪ ��
��1��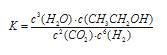
 ��2��< ��3��b d
��2��< ��3��b d
��4������CO2Ũ�ȣ�������ѹǿ��
��5������ ��Ӧ������������������������
��6��CH3CH2OH �C 12 e- + 3H2O ��2CO2 + 12H+
���������������1�����ݻ�ѧƽ�ⳣ������ʽ����дԭ�÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ���𰸣���2���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�ƶ���ƽ�ⳣ����С�����¶�Խ�ߣ�ƽ�ⳣ��ԽС���¶�T1��T2��K1��K2����3��a���������淴Ӧ���������Ϊƽ���־��ע�⡰˫��ͬʱ�����ϱ�����������1mol CH3CH2OH��ͬʱ������3mol H2O������ʾ����Ӧ���ʣ�����˵������ƽ�⣬����b�����淴Ӧ����ƽ��ʱ������ֵ����ʵ������䣬��ϵ�и���ݵ����ʵ���Ũ�Ȳ���ʱ����仯��˵������ƽ�⣬��ȷ��c����Ӧ�����������������䣬������������䣬�ܶ�ʼ�ղ��䣬��ϵ�л��������ܶȲ���ʱ����仯������˵������ƽ�⣬����d���淴Ӧ���л�������ܵ����ʵ�����С����ϵ������ķ����������٣���ϵ�����������������ʱ����仯��˵������ƽ�⣬��ȷ��ѡbd����4���ı������ӿ췴Ӧ���ʣ�ͬʱƽ��������Ӧ�ƶ�����������CO2Ũ�Ȼ�����ѹǿ����Ӧ���ʼӿ죬ƽ��������Ӧ�ƶ�������ת��������5����ͼ���֪����Ӧ�����������������������������ʸ÷�Ӧ��Ϊ���ȷ�Ӧ����6��ȼ�ϵ�ظ�����Ӧ������Ӧ���Ҵ��ڸ����ŵ磬�������������ɶ�����̼�������ӣ��缫��ӦʽΪ��CH3CH2OH-12 e-+3H2O=2CO2+12H+��
���㣺����ƽ�ⳣ������ѧƽ��״̬�жϡ���ѧƽ��Ӱ�����ء�ȼ�ϵ�صȡ�

��1000Kʱ����֪��ӦNi��s����H2O��g�� NiO��s����H2��g����ƽ�ⳣ��K��0.0059����ˮ���������������ʵ���Ũ�����ʱ���˷�Ӧ
NiO��s����H2��g����ƽ�ⳣ��K��0.0059����ˮ���������������ʵ���Ũ�����ʱ���˷�Ӧ
| A���Ѵ�ƽ��״̬ | B��δ��ƽ��״̬����Ӧ������� |
| C��δ��ƽ��״̬����Ӧ������� | D����ȷ�� |
��֪��(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ��H="74.9" kJ��mol-1������˵������ȷ����
| A���÷�Ӧ���ر䡢�ʱ�Դ���0 |
| B���÷�Ӧ�����ȷ�Ӧ�����һ�������Է����� |
| C��̼���ηֽⷴӦ�������ӣ�����κ�����������̼���ηֽ�һ���Է����� |
| D�����Է����еķ�Ӧһ���Ƿ��ȷ�Ӧ�������Է����еķ�Ӧһ�������ȷ�Ӧ |
һ���¶��£���2L�ܱ������з������з�Ӧ��4NO2(g)+O2(g) 2N2O5(g)����֪�÷�Ӧ��ƽ�ⳣ����
2N2O5(g)����֪�÷�Ӧ��ƽ�ⳣ���� ��
�� ������ϵ��
������ϵ��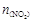 ����λ��mol����ʱ��仯���±���
����λ��mol����ʱ��仯���±���
| ʱ��(s) | 0 | 500 | 1000 | 1500 |
| t1�� | 20 | 13.96 | 10.08 | 10.08 |
| t2�� | 20 | a | b | c |
����˵��һ����ȷ���ǣ� ��
A������ӦΪ���ȷ�Ӧ
B�����t2�棼t1�棬��ô a��b=c����a=10+0.5b
C�����t2�棼t1�棬��ôt2��ﵽƽ���ʱ�����1000s��1500s֮��
D�����t2�棾t1�棬��ôb��10.08
���ݻ�������ܱ������м���1 mol N2��3 mol H2������Ӧ������������ȷ����
A���÷�Ӧ���Ȼ�ѧ����ʽΪ��N2 + 3H2 2NH3��H =��92 kJ/mol 2NH3��H =��92 kJ/mol |
| B���ﵽƽ�����������ͨ��1 mol������ƽ�ⲻ�ƶ� |
| C������b��ʾ����ʹ���˴��� |
| D�������¶Ⱥ���С�����������ʹ�÷�Ӧƽ�ⳣ������ |
���������У�������ƽ���ƶ�ԭ�����͵���
| A������ɫ��NO2����ѹ����ɫ�ȱ�����dz |
| B������ɫ����ˮ���պ���ɫ��dz |
| C����H2��Br2(g)��HBr(g)������ɵ�ƽ����ϵ��ѹ����ɫ���� |
| D����ҵ�ϳɰ���Ӧ�м�ѹ��������߰����IJ��� |
��֪2SO2 (g) + O2 (g)  2SO3 (g)����H����197 kJ��mol-1����ͬ�¡�ͬ����������ܱ������зֱ�������壺(��) 2 mol SO2��1 mol O2��(��) 1 mol SO2��0.5 mol O2��(��) 2 mol SO3�����¡������·�Ӧ��ƽ��ʱ�����й�ϵһ����ȷ����
2SO3 (g)����H����197 kJ��mol-1����ͬ�¡�ͬ����������ܱ������зֱ�������壺(��) 2 mol SO2��1 mol O2��(��) 1 mol SO2��0.5 mol O2��(��) 2 mol SO3�����¡������·�Ӧ��ƽ��ʱ�����й�ϵһ����ȷ����
| A��������ѹǿP��P����P�� > 2P�� |
| B��SO3������m��m����m�� > 2m�� |
| C��c(SO2)��c(O2)֮��k��k����k�� > k�� |
| D����Ӧ�ų���������������ֵQ��Q����Q�� > 2Q�� |
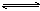 2Z(g)����H<0���ڲ�ͬ�¶ȡ���ͬѹǿ��p1��p2���£��ﵽƽ��ʱ�����������Z�İٷֺ������¶ȱ仯������ӦΪ
2Z(g)����H<0���ڲ�ͬ�¶ȡ���ͬѹǿ��p1��p2���£��ﵽƽ��ʱ�����������Z�İٷֺ������¶ȱ仯������ӦΪ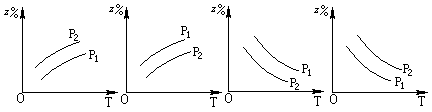
 eC(��)+fD(��)����Ӧ�����б��������������䣬C�������
eC(��)+fD(��)����Ӧ�����б��������������䣬C�������