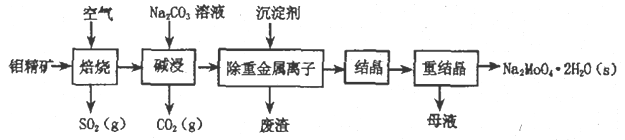
题目内容
【题目】已知:常温下,①Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-12 ②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(ɑ)随溶液pH的变化关系如图所示。下列叙述错误的是
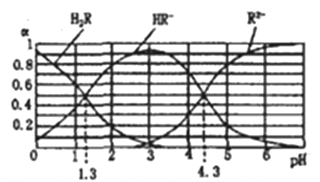
A. 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)
B. 向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R=2HCO3-+R2-
C. 在pH=1.3的溶液中存在![]() =10-3
=10-3
D. 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水大
【答案】D
【解析】A、在pH=4.3的溶液中,c(R2-)=c(HR-),溶液中电荷守恒为:2c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+),所以3c(R2-)=3c(HR-)=c(Na+)+c(H+)-c(OH-),故A正确; C、当溶液pH=1.3时,c(H2R)=c(HR-),则Ka1=![]() =10-1.3,溶液的pH=4.3时,c(R2-)=c(HR-),则Ka2=
=10-1.3,溶液的pH=4.3时,c(R2-)=c(HR-),则Ka2=![]() =10-4.3,
=10-4.3,![]() =
=![]() =10-3,故C正确;B、H2R的电离常数Ka2大于H2CO3的Ka2,即酸性:HR->HCO3-,所以向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R=2HCO3-+R2-,故B正确; D、等体积等浓度的NaOH溶液与H2R溶液混合后,生成等浓度的H2R、HR-,溶液的pH=1.3,溶液显酸性,对水的电离起到抑制作用,所以溶液中水的电离程度比纯水小,故D错误;故选D。
=10-3,故C正确;B、H2R的电离常数Ka2大于H2CO3的Ka2,即酸性:HR->HCO3-,所以向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R=2HCO3-+R2-,故B正确; D、等体积等浓度的NaOH溶液与H2R溶液混合后,生成等浓度的H2R、HR-,溶液的pH=1.3,溶液显酸性,对水的电离起到抑制作用,所以溶液中水的电离程度比纯水小,故D错误;故选D。

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目