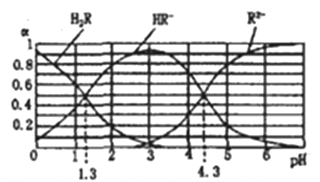
题目内容
【题目】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS 等)制备钼酸钠晶体的部分流程如下:
(1)Na2MoO4·2H2O 中钼元素的化合价为____________;焙烧时为了使钼精矿充分反应,可采取的措施是______________(答出一条即可)。
(2)写出焙烧附生成MoO3 的化学方程式为:_________________。
(3)写出“碱浸”反应的离子方程式:____________________。
(4)下图是碳钢在3 种不同介质中的腐蚀速率实验结果:
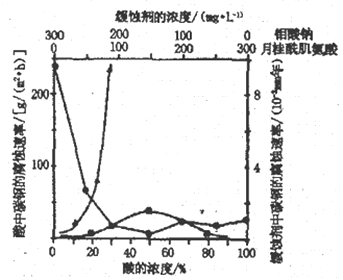

①当硫酸的浓度大于90%时,腐蚀速率几率为零,原因是__________________。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3 保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_________________。
③要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_______________。
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是:______________________。
Lix(MoS2)n。则电池放电时的正极反应式是:______________________。
(6)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-,当BaMoO4开始沉淀时,SO42-的去除率是__________。[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.0×10-10,Ksp(BaMoO4)=40×10-8加入Ba(OH)2固体引起的溶液体积变化可忽略。]
【答案】 +6 将矿石粉碎或增大空气的进入量或采用逆流原理 2MoS2+7O2=2MoO3+4SO2 MoO3+CO32-=MoO42-+CO2↑ 常温下浓硫酸具有强氧化性,会使铁钝化 替代空气中氧气起氧化剂作用 1:1 nMoS2+xLi++xe-=Lix(MoS2)n 97.5%
【解析】要弄懂原料及制备的产品,流程的第一步尽可能看懂。
(1)Na2MoO4·2H2O中钼元素的化合价为+6;焙烧时为了使钼精矿充分反应,可采取的措施是将矿石粉碎或增大空气的进入量或采用逆流原理等;
(2)先写出MoS2+ O2= MoO3+这一部分,可推断出另一产物为二氧化硫,利用氧化还原反应得失电子守恒和原子守恒配平,故其方程式为:2MoS2+7O2=2MoO3+4SO2;
(3)首先找到“碱浸”在流程图中的位置,注意,箭头指入的是加入的试剂,而指出的是产物,即加入Na2CO3,出来了CO2,还有MoO42-应从最后产物中获取信息,即MoO3+CO32-= MoO42-+CO2↑
(4)①此题一定要看懂图中横坐标与纵坐标所表示的是什么量,由图中可知,相同的酸度下,腐蚀速率不一样,可知是因为Cl-与SO42-的不同导致的;硫酸的浓度大于90%时,腐蚀速率几率为零,因为Fe在浓硫酸中会钝化;
②亚硝酸钠的作用,应从其性质去想,一是氧化性,二是强碱弱酸盐,在这里结合题目应用到其氧化性,故NaNO2的作用是故替代空气中氧气起氧化剂作用
③由坐标图中可读出当钼酸钠—月桂酸肌氨酸浓度为150 mg/L、150mg/L时,腐蚀速率是最低的,故要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为1:1;
(5)放电时,正极应是发生还原反应的,从总反应式中找到发生还原反应的物质为MoS2,而还原产物为Lix(MoS2)n,即nMoS2+e- +=Lix(MoS2)n,接下来是确定电子数和Li+的个数,根据电荷守恒,电子数与Li+的个数是相等的,故电极反应式为:nMoS2+xLi++xe-=Lix(MoS2)n ;
(6)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-,当BaMoO4开始沉淀时,BaSO4和BaMoO4都是AB型,Ksp(BaSO4)< Ksp(BaMoO4),故SO42-先沉淀,所以当BaMoO4开始沉淀时,c(Ba2+)=![]() =10-6mol/L,此时c(SO42-)=
=10-6mol/L,此时c(SO42-)=![]() =10-4mol/L,故SO42-的去除率是1-
=10-4mol/L,故SO42-的去除率是1-![]() =97.5%。
=97.5%。

【题目】下图是元素周期表的一部分,表中的①~⑨中元素,用元素符号或化学式填空回答:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为。
(2)地壳中含量最多的金属元素是。
(3)②与④形成的化合物的电子式。
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 , 碱性最强的是 , 呈两性的氢氧化物是。
【题目】SOCl2是一种重要氯化剂、锂电池的正极材料,还可作水合盐酸盐的脱水剂。
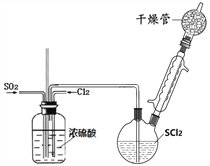
Ⅰ.一种模拟制备SOCl2装置如上图所示(夹持、加热装置略去),双颈瓶中加入25.4mL SCl2,通入纯净干燥Cl2、SO2混合气体,水浴条件下发生反应Cl2+SO2+SCl2=2SOCl2,几种物质的部分性质如下表所示:
密度/ g﹒mL-1 | 熔点/℃ | 沸点/℃ | 备注 | |
SCl2 | 1.62 | -122 | 59 | 40℃分解,遇水分解 |
SOCl2 | 1.64 | -104.5 | 76 | 76℃分解,遇水分解 |
(1)洗气瓶将气体混合并干燥,还有___________作用。
(2)干燥管中碱石灰作用__________。
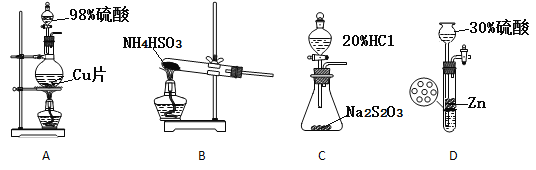
(3)实验室制取SO2装置和药品应选择____。
Ⅱ、双颈瓶换毛细玻璃管和蒸馏头,连接减压蒸馏装置,对粗产品减压初蒸,剩余液体继续减压蒸馏获得产品
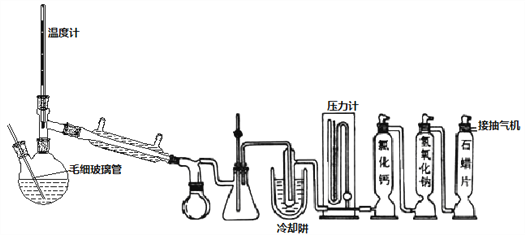
(4)不能用普通蒸馏方法分离混合物的原因是____。
(5)毛细玻璃管C作用是____________。初蒸水浴加热的温度应控制在____℃以下,再蒸馏获得产品25.4mL,则SOCl2产率为__________。
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应化学平衡常数的表达式:K=。
(2)该反应为(填“吸热”或“放热”)反应。