题目内容
4.根据下列提供的一组物质回答问题:①NH4Cl②MgCl2③H2S④Na2O2⑤MgO⑥Cl2⑦NaOH⑧CH4⑨NH3⑩CO2
(1)仅含共价键的是③⑥⑧⑨⑩;既有离子键又有共价键的是①④⑦.(用序号表示)
(2)离子化合物是①②④⑤⑥⑦;共价化合物是③⑧⑨⑩.(用序号表示)
(3)NH4Cl的电子式:
 ;Na2O2的电子式:
;Na2O2的电子式: ,H2S的电子式:
,H2S的电子式:
用电子式表达MgCl2的形成过程:
 .
.用电子式表达CO2的形成过程:
 .
.
分析 (1)离子键是阴阳离子间的静电作用,共价键是原子间通过共用电子对形成的相互作用;
(2)只含共价键的化合物属于共价化合物,含有离子键的化合物属于离子化合物;
(3)氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;
氧化钠是由2个钠离子与1个阳离子通过离子键结合而成的离子化合物;
H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键;
镁原子最外层有两个电子易失去最外层的2个电子形成稳定的镁离子,卤原子最外层有7个电子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁;
二氧化碳为共价化合物,碳原子与两个氧原子分别形成两对共用电子对.
解答 解:(1)①NH4Cl,含有离子键和共价键;
②MgCl2含有离子键;
③H2S只含有共价键;
④Na2O2含有离子键和共价键;
⑤MgO含有离子键;
⑥Cl2只含有共价键;
⑦NaOH,含有离子键和共价键;
⑧CH4只含有共价键;
⑨NH3只含有共价键;
⑩CO2只含有共价键;
仅含共价键的是:③⑥⑧⑨⑩; 既有离子键又有共价键的是①④⑦;
故答案为:③⑧⑨⑩;①④⑦;
(2)含有离子键的化合物有:①②④⑤⑥⑦,属于离子化合物;
只含有共价键的化合物有:③⑧⑨⑩,属于共价化合物;
故答案为:①②④⑤⑥⑦;③⑧⑨⑩;
(3)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ;
;
过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为: ;
;
H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: ;
;
镁原子失去最外层的2个电子形成稳定的镁离子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁,用电子式表示氯化镁的形成过程为 ;
;
二氧化碳为共价化合物,碳原子与两个氧原子分别形成两对共用电子对,用电子式表示二氧化碳的形成过程为: ;
;
故答案为: ;
; ;
; ;
; ;
; .
.
点评 本题考查了化学键类型的判断、电子式的书写,明确化学键的概念及形成条件,熟悉电子数书写的方法是解题关键,题目难度不大.

| A. | N2的结构式:N≡N | |
| B. | 氯元素的原子结构示意图: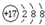 | |
| C. | 中子数为79、质子数为55 的铯(Cs)原子${\;}_{55}^{79}$Cs | |
| D. | 二氧化碳的电子式: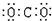 |
①混合气体的密度不再变化时
②容器内气体的压强不再变化时
③混合气体的总物质的量不再变化时
④B的物质的量浓度不再变化时
⑤混合气体的平均相对分子质量不再改变的状态
⑥当V正(B)=2V逆(C)
| A. | ①④⑤⑥ | B. | ②③⑥ | C. | ②④⑤⑥ | D. | 只有④ |

| A. | 2Ag+(aq)+Cd(s)=2Ag(s)+Cd 2+(aq) | B. | Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq) | ||
| C. | 2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s) | D. | 2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq) |
| A. | $\frac{4b-2a}{V}$ | B. | (2b-2a)/V | C. | (2b-a)/V | D. | (b-2a)/V |
| A. | X:3s23p1 Y:3s23p5 | B. | X:3d64s2 Y:2s22p4 | ||
| C. | X:3s23p2 Y:2s22p4 | D. | X:3s2 Y:2s22p3 |

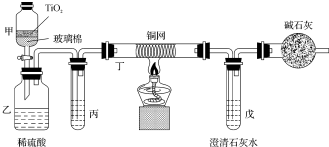
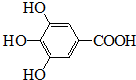 300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式为:
300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式为: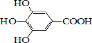 +4NaOH→
+4NaOH→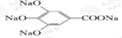 +4H2O.
+4H2O.