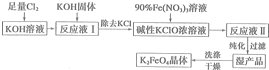
题目内容
19.溴化锂常用于制冷工业,可用尿素、碳酸锂及溴为原料生产溴化锂,其原理是3Br2+3Li2CO3+CO(NH4)2?6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
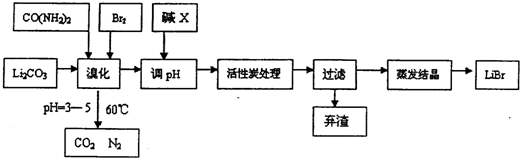
(1)溴化时,pH过小对反应不利,一方面是因为碳酸锂会反应生成CO2,另一方面使溴单质和水的反应平衡向逆反应方向移动,温度不宜超过60℃的原因是温度过高会加快溴蒸汽的挥发和次溴酸根会发生自身氧化还原反应.
(2)反应过程中,若pH>6,产品中会有溴酸盐,其原因是BrO-发生了自身的氧化还原反应,写出反应的离子方程式:3BrO-=BrO3-+2Br-.
(3)试剂X的化学式为LiOH,加活性炭处理的目的是吸附脱色.
(4)若直接用氨水代替尿素也可生产溴化锂,同时生成水、二氧化碳和氮气,该反应的化学方程式为3 Br2+3 Li2CO3+2 NH3.H2O=6LiBr+5 H2O+N2↑+3 CO2↑.
(5)用惰性电极电解熔融碳酸锂可得到金属锂,则阳极的电极方程式为2 CO32--4 e-=O2↑+2CO2↑.
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,据此能不能计算出溴化锂的产率?若能请写出其表达式(含m、n的表达式);若不能,请说明理由不能,因为在图示流程中加入的 LiOH也会生成LiBr.
分析 (1)溴化时,pH过小,酸性大,碳酸锂会反应生成CO2;另一方面溴单质和水的反应:Br2+H2O?H++Br-+HBrO,使平衡向逆反应方向移动;温度过高会加快溴蒸汽的挥发和次溴酸根会发生自身氧化还原反应;
(2)BrO-发生了自身的氧化还原反应,Br元素化合价升高和降低,反应生成BrO3-、Br-;
(3)调节pH溶液时不增加新杂质,根据阳离子是Li+判断碱的化学式;活性炭用于吸附脱色;
(4)由题干信息可知,氨水代与溴、碳酸锂反应生成溴化锂,同时生成水、二氧化碳和氮气,配平书写方程式;
(5)用惰性电极电解熔融碳酸锂可得到金属锂,阳极发生氧化反应,阴离子CO32-放电,碳酸根中氧元素发生氧化反应,反应生成二氧化碳与氧气;
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,因为在图示流程中加入的 LiOH也会生成LiBr,据此不能计算出溴化锂的产率.
解答 解:(1)溴化时,pH过小,酸性大,碳酸锂会反应生成CO2,另一方面溴单质和水的反应:Br2+H2O?H++Br-+HBrO,使平衡向逆反应方向移动;温度过高会加快溴蒸汽的挥发和次溴酸根会发生自身氧化还原反应,所以温度不宜超过60℃,
故答案为:CO2;逆反应方向;温度过高会加快溴蒸汽的挥发和次溴酸根会发生自身氧化还原反应;
(2)BrO-发生了自身的氧化还原反应,Br元素化合价升高和降低,反应生成BrO3-、Br-,反应离子方程式为:3BrO-=BrO3-+2 Br-,
故答案为:3BrO-=BrO3-+2 Br-;
(3)调节pH溶液时不增加新杂质,阳离子是Li+,故碱是LiOH;活性炭用于吸附脱色,
故答案为:LiOH;吸附脱色;
(4)由题干信息可知,氨水代与溴、碳酸锂反应生成溴化锂,同时生成水、二氧化碳和氮气,反应方程式为:3 Br2+3 Li2CO3+2 NH3.H2O=6LiBr+5 H2O+N2↑+3 CO2↑,
故答案为:3 Br2+3 Li2CO3+2 NH3.H2O=6LiBr+5 H2O+N2↑+3 CO2↑;
(5)用惰性电极电解熔融碳酸锂可得到金属锂,阳极发生氧化反应,阴离子CO32-放电,碳酸根中氧元素发生氧化反应,反应生成二氧化碳与氧气,电极反应式为:2 CO32--4 e-=O2↑+2CO2↑,
故答案为:2 CO32--4 e-=O2↑+2CO2↑;
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,因为在图示流程中加入的 LiOH也会生成LiBr,据此不能计算出溴化锂的产率,
故答案为:不能,因为在图示流程中加入的 LiOH也会生成LiBr.
点评 本题考查化学工艺流程、物质的分离提纯、对实验条件的分析评价、电极反应式书写等,(5)中电极反应式书写为易错点,是对学生综合能力的考查,难度中等.

 阅读快车系列答案
阅读快车系列答案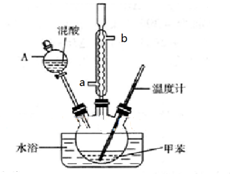
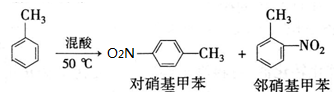
反应原理:
实验中可能用到的数据:
| 密度g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液体烃 |
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15g.
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许沸石(或碎瓷片),目的是防止爆沸.
(2)冷凝管的作用是冷凝回流;冷却水从冷凝管的a(填“a”或“b”)端进入.
(3)仪器A的名称是分液漏斗,使用该仪器前必须进行的操作是检查是否漏液.
(4)分离反应后产物的方案如下:

其中,操作1的名称为分液,操作2必需的玻璃仪器有酒精灯、温度计、锥形瓶、牛角管(尾接管)和蒸馏烧瓶、冷凝管.
(5)本实验中一硝基甲苯的产率为77.5%(结果保留小数点后一位数字).

| A. | 2Ag+(aq)+Cd(s)=2Ag(s)+Cd 2+(aq) | B. | Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq) | ||
| C. | 2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s) | D. | 2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq) |
 ,反应类型为加聚反应.
,反应类型为加聚反应.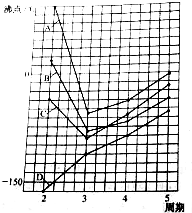 图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.
图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.