题目内容
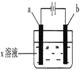
如图所示,下列实验现象的描述正确的是
| | a电极 | b电极 | x溶液 | 实 验 现 象 |
| A | 石墨 | 石墨 | CuCl2 | a极质量增加,b极放出无色气体 |
| B | Fe | 石墨 | KNO3 | a极质量增加,b极放出无色气体 |
| C | Fe | Cu | CuSO4 | a极质量增加,b极质量减少 |
| D | 石墨 | 石墨 | HCl | a极放出无色气体,b极放出无色气体 |
C
解析试题分析:由图可知:a是阴极,b是阳极。A.用惰性电极电解CuCl2溶液,在阴极发生反应:Cu2++2e-=Cu;在阳极发生反应:2Cl--2e-=Cl2↑; Cl2是黄绿色气体。因此会看到a极质量增加,b极放出黄绿色气体。错误。B.电解KNO3溶液实质是电解水。在阳极产生氧气,在阴极产生氢气,所以两个电极都放出无色无味的气体。错误。C.由于Cu的活性电极,所以在阳极b发生反应: Cu-2e-= Cu2+;在阴极发生反应:Cu2++2e-=Cu;因此a极质量增加,b极质量减少。正确。D用石墨作电极,电解HCl发生反应的方程式的2HCl H2+ Cl2,在a电极产生无色的氢气,在b电极产生黄绿色的氯气。错误。
H2+ Cl2,在a电极产生无色的氢气,在b电极产生黄绿色的氯气。错误。
考点:考查电解反应原理的应用的知识。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案如将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为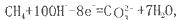 ,下列叙述正确的是
,下列叙述正确的是
| A.通入甲烷的一极为正极 |
| B.通入氧气的一极发生氧化反应 |
C.该电池总反应为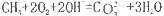 |
| D.该电池在工作时,溶液中的阴离子向正极移动 |
滴有酚酞和氯化钠试液的湿润滤纸分别做甲乙两个实验,能发现附近变成红色的电极是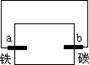
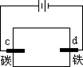
甲 乙
| A. a、c | B. b、d | C. a、d | D. b、c |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O |
| C.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g |
| D.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ |
下图是一种燃料型电池检测仪的工作原理示意图。下列说法不正确的是 ( )
| A.该仪器工作时酒精浓度越大,则电流强度越大 |
| B.工作时处电路电子流向为X→Y |
| C.检测结束后,X极区的pH增大 |
| D.电池总反应为2CH3CH2OH+O2=2CH3CHO+2H2O |
某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是 ( )
| A.放电时,LiMn2O4发生氧化反应 |
| B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4 |
| C.充电时,LiMn2O4发生氧化反应 |
| D.充电时,阳极反应为:Li++e-==Li |
中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池。如图,下列有关分析正确的是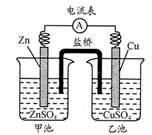
| A.负极发生氧化反应:Cu—2e—=Cu2+ |
| B.电池工作时,盐桥逐渐变蓝 |
| C.向乙池中通入H2S后,电池反应停止 |
| D.若将电极Cu改为石墨,电池电流强度发生变化 |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是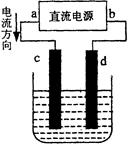
| A.a为负极、b为正极 | B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 | D.电解过程中,氯离子浓度不变 |