题目内容
下列说法中正确的是
| A.在船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率 |
| B.粗铜精炼时,电解液中的c(Cu2+)保持不变 |
| C.Na+的焰色反应呈黄色,属于化学变化 |
| D.在滴定实验中,可以用碱式滴定管量取21.0 mL的NaOH溶液 |
A
解析试题分析:A、在船体上镶嵌锌块,为牺牲阳极保护法,可以减缓船体被海水腐蚀的速率,正确;B、粗铜精炼时,由于粗铜中比铜活泼的金属失电子以离子形式进入电解液,阴极只有铜离子放电生成单质铜,故电解液中的c(Cu2+)减小,错误; C、焰色反应为元素的性质,属于物理变化,错误;D、滴定管的精确度为0.01mL,在滴定实验中,可以用碱式滴定管量取21.00 mL的NaOH溶液,错误。
考点:考查原电池原理和电解原理的应用及化学实验基本操作。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案以Fe为阳极,Pt为阴极,对足量的 Na2SO4 溶液进行电解,一段时间后得到4 mol Fe(OH)3沉淀,此间共消耗水的物质的量为 ( )
| A.6mol | B.8mol | C.10mol | D.12mol |
用铂电极电解100mL HNO3与 AgNO3的混合液,通电一段时间后,两极均收集到2.24 L 气体(标准状况),则原混合液中Ag+的物质的量浓度为 ( )
| A.1mol/L | B.2mol/L | C.2.5mol/L | D.3mol/L |
用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是 ( )
| A.铜棒为正极,其电极反应式为:2H++2e-====H2↑ |
| B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出 |
| C.反应中消耗锌的质量为13 g |
| D.导线中通过电子的物质的量为0.2 mol |
中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池。如图,下列有关分析正确的是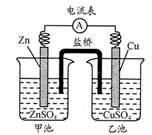
| A.负极发生氧化反应:Cu—2e—=Cu2+ |
| B.电池工作时,盐桥逐渐变蓝 |
| C.向乙池中通入H2S后,电池反应停止 |
| D.若将电极Cu改为石墨,电池电流强度发生变化 |
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 负极 Li-e-="=" Li+下列说法中正确的是
| A.充电时电池反应为FePO4+Li = LiFePO4 |
| B.充电时动力电池上标注“+”的电极应与外接电的正极相连 |
| C.放电时电池内部Li+向负极移动 |
| D.放电时,在正极上是Li+得电子被还原 |
以葡萄糖为燃料的微生物燃料电池结构如右图所示。a为电池的正极,关于该电池的叙述正确的是
| A.该电池能够在高温下工作 | B.b电极发生还原反应 |
| C.O2在a电极被氧化 | D.电流从a电极经用电器流向b电极 |
(2014?长宁区一模)①②③④甲种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是( )
| A.①③②④ | B.①③④② | C.③④②① | D.③①②④ |
下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是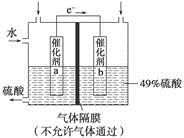
| A.该装置将化学能转化为电能 |
| B.催化剂b表面O2发生还原反应,其附近酸性增强 |
| C.催化剂a表面的反应是SO2+2H2O-2e-===SO42-+4H+ |
| D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15 |