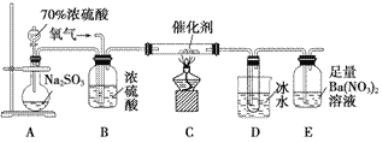
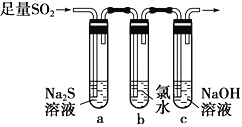
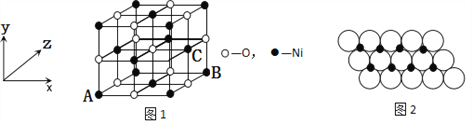
题目内容
【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g) ![]() 2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
A. 生成C的速率与A的消耗的速率相等
B. A、B、C的浓度相等
C. 单位时间生成n mol A,同时生成 2n mol C
D. A、B、C的分子数之比为 1∶3∶2
【答案】C
【解析】A、生成C的速率与A的消耗的速率相等,都表示正反应速率,不能说明达到了平衡状态,故A错误;B、各组分的浓度相等,不能证明各组分的浓度不变,无法判断是否达到了平衡状态,故B错误;C、单位时间生成n mol A,同时生成 2n mol C,表示正逆反应速率相等,说明达到平衡状态,故C正确;D、各组分的分子数之比,无法判断各组分的浓度是否变化,无法判断是否达到平衡状态,故D错误;故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目