��Ŀ����
����Ŀ��ij�о�С��������ͼװ��̽���¶ȶ�CO��ԭFe2O3��Ӱ��(�̶�װ����)
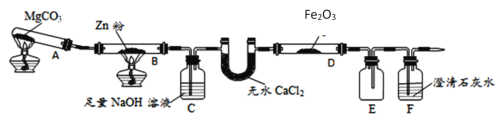
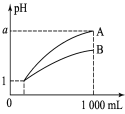
(1)ͼ��ʢ��ˮCaCl2����������Ϊ______װ��B�еĻ�ѧ��Ӧ����ʽΪ_______��
(2)װ��C�з�����Ӧ�����ӷ���ʽΪ_________������β���ķ���Ϊ________��
(3)���о�С���Ϊ���飬����ͼװ�ý��жԱ�ʵ�飬̽����ͬ�¶������º�ɫ����ijɷ֣������þƾ��ơ������þƾ���ƶ�װ��D���ȣ���Ӧ�����Ϊ��ɫ��ĩ(������)������ֱ��ò����������ʵ�飺
���� | ���� | �������� | �������� |
1 | ȡ��ɫ��ĩ�������� | �ܽ⣬������ | �ܽ⣬������ |
2 | ȡ����1����Һ���μ�K3[Fe(CN)6]��Һ | ��ɫ���� | ��ɫ���� |
3 | ȡ����1����Һ���μ�KSCN��Һ | ��� | ������ |
4 | ȡ����3��Һ�еμ�������ˮ | ��ɫ��ȥ | �ȱ�죬����ɫ |
������õ��ĺ�ɫ��ĩ�ɷ���________��
�ڸ��ݼ���ʵ������д�����鲽��1�з�Ӧ�����ӷ�ʽ__________��
�����鲽��4�У���Һ����ԭ��Ϊ________����Һ��ɫ���ܵ�ԭ��________������֤����Ϊ________��
���𰸡�U�θ���� Zn+CO2=ZnO+CO CO2+2OH-=CO32��+H2O ��ȼ���������ռ� Fe Fe3O4+8H+��2Fe3++Fe2++4H2O Fe2+������ΪFe3+��Fe3+��SCN-�Ժ�ɫ ����SCN-��Cl2���� ����Һ�м���KSCN��Һ�������ֺ�ɫ����������
��������
��1��ͼ��ʢ��ˮCaCl2����������ΪU�θ���ܣ�����װ��B�е������Ƕ�����̼���壬�����ķ�Ӧ�Ƕ�����̼��п����������п��һ����̼��
��2��CO2��Zn��������CO���壬װ��C��NaOH����������CO�л��е�CO2���壻β����CO�����������ȼ�Բ�ȡ��ȼ��������β��������
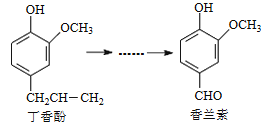
��3�������ú�ɫ������������Ტ�������壬�����ԭ���غ�����֪�þƾ���Ƶ�����ʵ��õ��Ĺ���ΪFe��
��Fe2O3����ԭ�õ���ɫ����ΪFe3O4���ɴ˿�д����Ӧ�����ӷ���ʽ��
������4����Һ�������Һ��Fe2+��Cl2����ΪFe3+���¡���Һ��ɫ��ԭ�������Cl2��SCN-���������ü������������Һ�л�����Fe3+���ټ�������KSCN��Һ����Һ��죻
��1��ͼ��ʢ��ˮCaCl2����������ΪU�θ���ܣ�����װ��B�е������Ƕ�����̼���壬�����ķ�Ӧ�Ƕ�����̼��п����������п��һ����̼����Ӧ�Ļ�ѧ����ʽ�ǣ�Zn+CO2=ZnO+CO��
�ʴ�Ϊ��U�θ���ܣ�Zn+CO2=ZnO+CO��
��2�����ʵ��Ŀ�Ŀ�֪��װ��B����CO2��Zn��������CO���壬�������װ�ý���ʵ�飬��װ��C��NaOH����������CO�л��е�CO2���壬���ӷ���ʽ�ǣ�CO2+2OH-=CO32��+H2O��CO���岻һ����ȫ��Ӧ�����β���л���CO�����������ȼ�Բ�ȡ��ȼ��������β��������
�ʴ�Ϊ��CO2+2OH-=CO32��+H2O����ȼ���������ռ���
��3�������ú�ɫ������������Ტ�������壬��ϡ�ԭ���غ㡱��֪�þƾ���Ƶ�����ʵ��õ��Ĺ���ΪFe��
�ʴ�Ϊ��Fe��
�����ü��������֪Fe2O3��CO�ھƾ��Ƽ��ȵ������£�Fe2O3����ԭ�õ���ɫ����ΪFe3O4���ɴ˿�д����Ӧ�����ӷ���ʽ��
�ʴ�Ϊ��Fe3O4+8H+��2Fe3++Fe2++4H2O ��
����Fe3+��SCN-�Ժ�ɫ�����Բ���4����Һ�������Һ��Fe2+��Cl2����ΪFe3+���¡���Һ��ɫ��ԭ�������Cl2��SCN-���������ü������������Һ�л�����Fe3+���ټ�������KSCN��Һ����Һ��죬
�ʴ�Ϊ��Fe2+������ΪFe3+��Fe3+��SCN-�Ժ�ɫ������SCN-��Cl2����������Һ�м���KSCN��Һ�������ֺ�ɫ������������

 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�����Ŀ��ijͬѧ̽��Cu��NO�ķ�Ӧ���������ϣ���Cu��NO��Ӧ������CuO��N2�������������£�NO��NO2�C������MnO4�C��Ӧ����NO3�C��Mn2+
��1��ʵ��������Cu��ϡHNO3�Ʊ�NO��д����Ӧ�Ļ�ѧ����ʽ_____________��
��2��ѡ����ͼ��ʾװ�����Cu��NO��ʵ�顣(�г�װ����) ʵ�鿪ʼǰ����װ����ͨ��һ��ʱ���N2���ش��������⣺
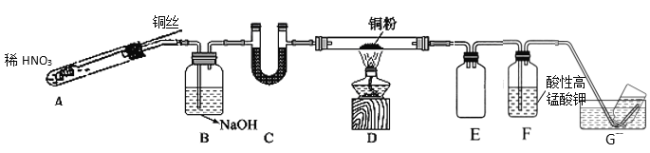
��ʹ��ͭ˿���ŵ���_____________________װ��E������Ϊ_______________��
��װ��C��ʢ�ŵ�ҩƷ������_________��
��װ��D�е�������_______________��װ��F�з�Ӧ�����ӷ���ʽ��_______________��
��3���ⶨNaNO2��NaNO3 �����Һ��NaNO2��Ũ�ȡ� ȡ25.00mL�����Һ����ƿ�У���0.1000mol��L��1����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
����� | 1 | 2 | 3 | 4 |
����KMnO4��Һ���/mL | 20.90 | 20.12 | 20.00 | 19.88 |
����һ��ʵ�����ݳ����쳣����������쳣��ԭ�������_________������ĸ���ţ���
a����ƿϴ����δ����
b����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
c���ζ��յ�ʱ���Ӷ���
d������KMnO4��Һ�к��������������Լ�
e����ƿϴ�����ô���Һ��ϴ
������KMnO4��Һ�ζ�����������Һ�����ӷ���ʽΪ___________________��
��NaNO2 �����ʵ���Ũ��Ϊ__________