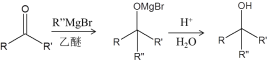题目内容
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.36g冰中含有氢键的数目为2NA
B.100g30%的甲醛水溶液中所含的氧原子数目为1NA
C.1molCl2与足量铁粉完全燃烧,转移的电子数为3NA
D.14gFe发生电化学腐蚀最终生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
【答案】D
【解析】
A.如图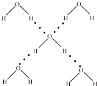 ,每摩尔水分子都和4个水分子形成氢键,而每个氢键被两个水分子共有,所以1mol水能够形成2mol氢键,所以36g冰中含有氢键的数目最多为4NA,故A错误;
,每摩尔水分子都和4个水分子形成氢键,而每个氢键被两个水分子共有,所以1mol水能够形成2mol氢键,所以36g冰中含有氢键的数目最多为4NA,故A错误;
B.甲醛和水分子中均含有氧原子,100g30%的甲醛水溶液中所含的氧原子数目多于1NA,故B错误;
C.1molCl2与足量铁粉完全燃烧,生成物中氯显-1价,转移的电子数为2NA,故C错误;
D.14g铁的物质的量为n=![]() =0.25mol,而铁反应生成Fe2O3·xH2O后,铁的价态由0价变为+3价,但0.25mol铁的电极反应为Fe-2e-=Fe2+,电极反应转移的电子数为0.5NA,故D正确;
=0.25mol,而铁反应生成Fe2O3·xH2O后,铁的价态由0价变为+3价,但0.25mol铁的电极反应为Fe-2e-=Fe2+,电极反应转移的电子数为0.5NA,故D正确;
故选D。

练习册系列答案
相关题目