题目内容
【题目】研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。NO2可用下列反应来处理:
6NO2(g)+8NH3(g) ![]() 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。
(1)120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡。10min时氧化产物比还原产物多了1.4g,则0~10min时,平均反应速率υ(NO2) = ____________________ ,电子转移了 ___________ 个。
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是____________。
a.c(NO2):c(NH3) = 3:4 b.6v(NO2)正 = 7v(N2)逆
c.容器内气体总压强不再变化 d.容器内气体密度不再变化
(3)若保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比_________ (填增大、不变、减小),NO2的转化率 ______________。
(4)一定条件下NO2与SO2可发生反应,方程式:NO2(g)+SO2(g)![]() SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
a.一定向正反应方向移动 b. 平衡移动时,逆反应速率先减小后增大
c.一定向逆反应方向移动 d. 平衡移动时,正反应速率先增大后减小
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式___________。
【答案】0.015mol/(L·min) 1.2NA c 增大 减小 ad NO + NO2+2OH- =2NO2-+ H2O
【解析】
(1)利用化合价变化判断氧化产物、还原产物,然后根据“氧化产物比还原产物多了1.4g”计算出消耗二氧化氮的物质的量及转移电子的物质的量;
(2)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度不再变化,据此进行判断;
(3)缩小反应容器体积,增大了压强,平衡向着逆向移动,据此判断二氧化氮与氮气的浓度之比变化及二氧化氮的转化率变化;
(4)反应的平衡常数K值变大,只有改变温度使得平衡正向移动;
(5)用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体,恰好反应生成亚硝酸钠和水。
(1)对于6NO2(g)+8NH3(g) ![]() 7N2(g)+12H2O(g),当有6molNO2反应共转移了24mol电子,该反应的氧化产物和还原产物都是氮气,根据N原子守恒,6mol二氧化氮反应生成4mol氧化产物、3mol还原产物,氧化产物比还原产物多1mol,质量多:28g/mol×1mol=28g,则氧化产物比还原产物多了1.4g时转移电子的物质的量为:24mol×
7N2(g)+12H2O(g),当有6molNO2反应共转移了24mol电子,该反应的氧化产物和还原产物都是氮气,根据N原子守恒,6mol二氧化氮反应生成4mol氧化产物、3mol还原产物,氧化产物比还原产物多1mol,质量多:28g/mol×1mol=28g,则氧化产物比还原产物多了1.4g时转移电子的物质的量为:24mol×![]() =1.2mol,转移电子数为1.2NA;参加反应的NO2为:6mol×
=1.2mol,转移电子数为1.2NA;参加反应的NO2为:6mol×![]() =0.3mol,则0~10min时,平均反应速率υ(NO2)=
=0.3mol,则0~10min时,平均反应速率υ(NO2)=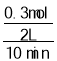 =0.015mol/(Lmin),故答案为:0.015mol/(Lmin);1.2NA ;
=0.015mol/(Lmin),故答案为:0.015mol/(Lmin);1.2NA ;
(2)a.c(NO2):c(NH3)=3:4,无法判断各组分的浓度是否变化,则无法判断是否达到平衡状态,故a错误;
b.6v(NO2)正=7v(N2)逆,表示的是正逆反应速率,但是不满足计量数关系,所以没有达到平衡状态,故b错误;
c.容器内气体总压强不再变化:该反应前后气体体积不相等,则反应过程中压强会发生变化,当压强不变时,表明正逆反应速率相等,达到平衡状态,故c正确;
d.容器内气体密度不再变化:该反应过程中气体的密度始终不变,无法根据密度变化判断平衡状态,故d错误;
故答案为:c;
(3)若保持其它条件不变,缩小反应容器的体积后达到新的平衡,由于增大了压强,平衡向着逆向移动,导致二氧化氮的含量增大、氮气的含量减小,所以此时NO2和N2的浓度之比增大,NO2的转化率减小,故答案为:增大;减小;
(4)化学平衡常数只随温度的变化而变化,该反应为吸热反应,平衡常数K值变大说明温度升高平衡右移,正反应速率先增大后减小,逆反应速率先增大再继续增大,故ad正确,故答案为:ad;
(5)用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体,反应的离子方程式为:NO+NO2+2OH-=2NO2-+H2O,故答案为:NO+NO2+2OH-=2NO2-+H2O。

【题目】电石中的碳化钙和水能完全反应![]() ,使反应产生的气体排水,测量出水的体积,可计算出标准状况下乙炔的体积,从而测定电石中碳化钙的含量:
,使反应产生的气体排水,测量出水的体积,可计算出标准状况下乙炔的体积,从而测定电石中碳化钙的含量:
(1)若用下列仪器和导管组装实验装置:
序号 | 1 | 2 | 3 | 4 | 5 | 6 |
导管及仪器 |
|
|
|
|
|
|
每个橡皮塞上都打了两个孔 | ||||||
如果所制气体流向从左向右时,上述仪器和导管从从上到下,从左到右直接连接的顺序(填各仪器,导管的序号) 接 接 接 接 接 。_________
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次)
①称取一定量电石,置于仪器3中,塞紧橡皮塞
②检查装置的气密性
③在仪器6和5中注入适量水
④待仪器3恢复至室温时,量取仪器4中水的体积(导管2中水的体积忽略不计)
⑤慢慢开启仪器6 的活塞,使水逐滴滴下至不发生气体时,关闭活塞。
正确操作顺序(用操作编号填写)是____________________________
(3)若实验中产生的气体存在难闻的气味,且测定结果偏大,这是因为电石中含有杂质气体,可以用___________________(填试剂)加以除去。