题目内容
【题目】铜生锈会生成铜绿[Cu2(OH)2CO3],铜绿受热易分解,化学方程式为:Cu2(OH)2CO3 ![]() 2CuO+H2O+CO2↑。
2CuO+H2O+CO2↑。
(1)部分锈蚀成铜绿的铜片隔绝空气加热,完全反应后固体质量减少了9.3g,则生锈的铜片中铜绿的质量为___________g
(2)将35g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液PH值为1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到39.2g蓝色固体。(假设反应前后溶液的体积不变)
①已锈蚀的铜片中的铜元素的质量分数为________。(保留两位小数)
②铜片中单质铜的物质的量为________mol。
(3)若生成NO2和NO混合气体共a L(S.P.T)。
①求a的取值范围(写出详细解答过程)________。
②求原硝酸的物质的量浓度(用含a的代数式表示,写出详细解答过程)________。
【答案】33.3 73.14% 0.2 Cu与硝酸反应,假设只生成NO,由方程式3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O可知,Cu为0.2mol,则NO为![]() mol,其体积为
mol,其体积为![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L, Cu与硝酸反应,假设只生成NO2,由方程式Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O可知,Cu为0.2mol,则NO为0.4mol,其体积为0.4mol×22.4L/mol=8.96L,实际上生成的是两种气体,则体积在两者之间,即
L, Cu与硝酸反应,假设只生成NO2,由方程式Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O可知,Cu为0.2mol,则NO为0.4mol,其体积为0.4mol×22.4L/mol=8.96L,实际上生成的是两种气体,则体积在两者之间,即![]() <a<8.96 表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片与硝酸反应生成硝酸铜和氮的氧化物,溶液中还有剩余的硝酸,加NaOH溶液硝酸铜转化为氢氧化铜沉淀, Cu(OH)2的物质的量为
<a<8.96 表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片与硝酸反应生成硝酸铜和氮的氧化物,溶液中还有剩余的硝酸,加NaOH溶液硝酸铜转化为氢氧化铜沉淀, Cu(OH)2的物质的量为![]() =0.4mol,
=0.4mol,
![]()
反应后溶液pH为1,溶液中剩余的硝酸为0.1mol/L×0.1L=0.01mol,所以硝酸的总物质的量为0.8mol+0.01mol+![]() mol,所以硝酸的浓度为(8.1+
mol,所以硝酸的浓度为(8.1+![]() )mol/L
)mol/L
【解析】
(1)固体减少的质量为二氧化碳和水的质量之和,根据方程式计算铜绿的质量;
(2)①39.2g蓝色固体为氢氧化铜,根据Cu原子守恒计算Cu元素的质量,再求出Cu的质量分数;
②设固体中Cu2(OH)2CO3的物质的量为xmol,Cu的物质的量为ymol,根据铜原子守恒和已知质量列式计算;
(4)①Cu与硝酸反应,Cu失去的电子的物质的量等于气体得到的电子的物质的量,假设只生成NO求出气体的体积,或者假设只生成NO2再求出气体的体积,实际上生成的是两种气体,则体积在两者之间;
②表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片与硝酸反应生成硝酸铜和氮的氧化物,溶液中还有剩余的硝酸,根据氮原子守恒计算。
(1)固体减少的质量为二氧化碳和水的质量之和,则二氧化碳和水的质量之和为9.3g,设铜绿的质量为xg,
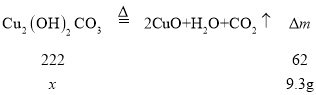
则x=![]() =33.3g;故答案为:33.3;
=33.3g;故答案为:33.3;
(2)39.2g蓝色固体为氢氧化铜,则氢氧化铜中Cu元素的质量为![]() =25.6g,则Cu的质量分数为
=25.6g,则Cu的质量分数为![]() ×100%=73.14%;故答案为:73.14%;
×100%=73.14%;故答案为:73.14%;
(3)设固体中Cu2(OH)2CO3的物质的量为xmol,Cu的物质的量为ymol,已知铜绿和铜的总质量为35g,生成氢氧化铜沉淀的质量为39.2g,则222x+64y=35g, 98(2x+y)=39.2g,解得:x=0.1,y=0.2,故答案为:0.2;
(4)①Cu与硝酸反应,假设只生成NO,由方程式3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O可知,Cu为0.2mol,则NO为![]() mol,其体积为
mol,其体积为![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L, Cu与硝酸反应,假设只生成
L, Cu与硝酸反应,假设只生成![]() <a<8.96;故答案为:
<a<8.96;故答案为:![]() <a<8.96;
<a<8.96;
②表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片与硝酸反应生成硝酸铜和氮的氧化物,溶液中还有剩余的硝酸,加NaOH溶液硝酸铜转化为氢氧化铜沉淀, Cu(OH)2的物质的量为![]() =0.4mol,
=0.4mol,
![]()
反应后溶液pH为1,溶液中剩余的硝酸为0.1mol/L×0.1L=0.01mol,所以硝酸的总物质的量为0.8mol+0.01mol+![]() mol,所以硝酸的浓度为(8.1+
mol,所以硝酸的浓度为(8.1+![]() )mol/L;故答案为:(8.1+
)mol/L;故答案为:(8.1+![]() )mol/L。
)mol/L。