题目内容
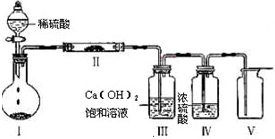
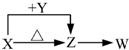
 X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,具体反应条件未列出).
X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,具体反应条件未列出).
(1)若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
①常温下,W单质以______态形式存在,加热W单质,蒸汽呈______.
②工业上Z的用途很广泛,请用化学方程式写出Z的一种用途:______.
③生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是______.
(2)若X是工业上用量最大的金属单质,Y是一种具有磁性的黑色晶体,则X与Y反应的化学方程式是______.
解:(1)若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则W为I2,Z为NaCl,
①碘常温下为固态,加热易升华,得到紫色的蒸气,故答案为:固态;紫色;
②NaCl在氯碱工业中有重要的原料,反应为2NaCl+2H2O H2↑+Cl2↑+2NaOH,故答案为:2NaCl+2H2O
H2↑+Cl2↑+2NaOH,故答案为:2NaCl+2H2O H2↑+Cl2↑+2NaOH;
H2↑+Cl2↑+2NaOH;
③X为氯气,Y为NaI,过量X与Y溶液反应时可以得到一种碘酸盐为碘酸钠,该离子反应为3Cl2+I-+3H2O═6Cl-+IO3-+6H+,故答案为:3Cl2+I-+3H2O═6Cl-+IO3-+6H+;
(2)X是工业上用量最大的金属单质,Y是一种具有磁性的黑色晶体,则X为Al,Y为Fe3O4,二者发生铝热反应,反应为3Fe3O4+8Al 9Fe+4Al2O3,
9Fe+4Al2O3,
故答案为:3Fe3O4+8Al 9Fe+4Al2O3.
9Fe+4Al2O3.
分析:(1)若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则W为I2,碘易升华,Z为NaCl,在氯碱工业中有重要的应用,X为氯气,Y为NaI,过量X与Y溶液反应时可以得到一种碘酸盐为碘酸钠;
(2)X是工业上用量最大的金属单质,Y是一种具有磁性的黑色晶体,则X为Al,Y为Fe3O4,二者发生铝热反应.
点评:本题考查无机物的推断,明确卤素单质之间的置换反应及铝热反应是解答的关键,注意碘的特性及Y的特性是解答的突破口,题目难度不大.
①碘常温下为固态,加热易升华,得到紫色的蒸气,故答案为:固态;紫色;
②NaCl在氯碱工业中有重要的原料,反应为2NaCl+2H2O
 H2↑+Cl2↑+2NaOH,故答案为:2NaCl+2H2O
H2↑+Cl2↑+2NaOH,故答案为:2NaCl+2H2O H2↑+Cl2↑+2NaOH;
H2↑+Cl2↑+2NaOH;③X为氯气,Y为NaI,过量X与Y溶液反应时可以得到一种碘酸盐为碘酸钠,该离子反应为3Cl2+I-+3H2O═6Cl-+IO3-+6H+,故答案为:3Cl2+I-+3H2O═6Cl-+IO3-+6H+;
(2)X是工业上用量最大的金属单质,Y是一种具有磁性的黑色晶体,则X为Al,Y为Fe3O4,二者发生铝热反应,反应为3Fe3O4+8Al
 9Fe+4Al2O3,
9Fe+4Al2O3,故答案为:3Fe3O4+8Al
 9Fe+4Al2O3.
9Fe+4Al2O3.分析:(1)若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则W为I2,碘易升华,Z为NaCl,在氯碱工业中有重要的应用,X为氯气,Y为NaI,过量X与Y溶液反应时可以得到一种碘酸盐为碘酸钠;
(2)X是工业上用量最大的金属单质,Y是一种具有磁性的黑色晶体,则X为Al,Y为Fe3O4,二者发生铝热反应.
点评:本题考查无机物的推断,明确卤素单质之间的置换反应及铝热反应是解答的关键,注意碘的特性及Y的特性是解答的突破口,题目难度不大.

练习册系列答案
相关题目

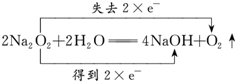
 X、Y、Z、W四种化合物均由常见元素组成,其中X含有四种元素,Y、Z含有三种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有如图转化关系(部分反应物、产物及反应条件已略去).请回答:
X、Y、Z、W四种化合物均由常见元素组成,其中X含有四种元素,Y、Z含有三种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有如图转化关系(部分反应物、产物及反应条件已略去).请回答: