题目内容
X、Y、Z、W四种化合物均由1~20号元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去).请回答:

(1)写出下列物质的化学式:X
(2)X与Y在溶液中反应的离子方程式是
X→Z的化学方程式

(1)写出下列物质的化学式:X
NaHCO3
NaHCO3
;YNaOH
NaOH
;WCO2
CO2
.(2)X与Y在溶液中反应的离子方程式是
HCO3-+OH-=CO32-+H2O
HCO3-+OH-=CO32-+H2O
.X→Z的化学方程式
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
X的热稳定性
| ||
小于
小于
(大于、小于或等于)Z.分析:(1)根据图示和题目信息可知 X是NaHCO3,进而推知其他物质.
(2)根据NaHCO3的化学性质思考.
(2)根据NaHCO3的化学性质思考.
解答:解:(1)X、Y、Z的焰色反应均为黄色,说明它们都是含钠化合物,且X含有4种元素,加热可生成Z,则X是受热可以分解的NaHCO3,Z是Na2CO3.因为X与Y反应生成Z,所以Y是NaOH.由于W是无色无味气体,则W只能是Na2CO3 与酸反应生成的CO2.即X是NaHCO3,Y是NaOH,Z是Na2CO3,W是CO2,
故答案为:NaHCO3;NaOH;CO2;
(2)NaHCO3与NaOH在水溶液中发生的反应是NaHCO3+NaOH═Na2CO3+H2O,其离子方程式HCO3-+OH-=CO32-+H2O.NaHCO3 受热易分解,其化学方程式是2NaHCO3
Na2CO3+H2O+CO2↑,说明NaHCO3的热稳定性比 Na2CO3弱,即小于.
故答案为:HCO3-+OH-=CO32-+H2O;2NaHCO3
Na2CO3+H2O+CO2↑; 小于.
故答案为:NaHCO3;NaOH;CO2;
(2)NaHCO3与NaOH在水溶液中发生的反应是NaHCO3+NaOH═Na2CO3+H2O,其离子方程式HCO3-+OH-=CO32-+H2O.NaHCO3 受热易分解,其化学方程式是2NaHCO3
| ||
故答案为:HCO3-+OH-=CO32-+H2O;2NaHCO3
| ||
点评:本题要把含钠化合物的性质与题意结合起来,以NaHCO3为突破口,逐个判断.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
 (2011?江苏)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
(2011?江苏)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.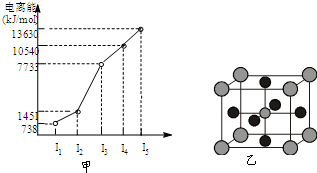 有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn.
有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn. 原子序数小于36的X、Y、Z、W四种元素,其中X原子基态时2p原子轨道上有3个未成对电子,Y原子基态时最外层电子数是其内层电子数的3倍,Z元素的最高价氧化物的水化物的酸性最强,W的原子序数为30.
原子序数小于36的X、Y、Z、W四种元素,其中X原子基态时2p原子轨道上有3个未成对电子,Y原子基态时最外层电子数是其内层电子数的3倍,Z元素的最高价氧化物的水化物的酸性最强,W的原子序数为30.