题目内容
在100mLH2SO4和CuSO4的混合液中,用石墨做电极电解,两极上均收集到2.24L气体(标准状况下),则原混合液中,Cu2+的物质的量浓度为( )。
| A.1mol?L-1 | B.2mol?L-1 | C.3mol?L-1 | D.4mol?L-1 |
A
解析试题分析:用石墨做电极电解100mLH2SO4和CuSO4的混合液,首先发生反应:2CuSO4+2H2O 2Cu+ O2↑+2H2SO4;当溶液中的硫酸铜反应完全后,发生反应:2H2O
2Cu+ O2↑+2H2SO4;当溶液中的硫酸铜反应完全后,发生反应:2H2O 2H2↑+O2↑。若两个电极产生的气体的物质的量都是0.1mol,根据整个电路中电子转移数目相等可得:2n(Cu)+2n(H2)="4" n(O2)。2n(Cu)=" 4" n(O2)-2n(H2)=0.1×4-0.1×2=0.2,所以n(Cu)=0.1mol。则原混合液中,Cu2+的物质的量浓度为0.1mol÷0.1L=1mol/L,因此选项是A。
2H2↑+O2↑。若两个电极产生的气体的物质的量都是0.1mol,根据整个电路中电子转移数目相等可得:2n(Cu)+2n(H2)="4" n(O2)。2n(Cu)=" 4" n(O2)-2n(H2)=0.1×4-0.1×2=0.2,所以n(Cu)=0.1mol。则原混合液中,Cu2+的物质的量浓度为0.1mol÷0.1L=1mol/L,因此选项是A。
考点:考查守恒法在电解反应原理中的应用的知识。

某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度为 mol/L
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是( )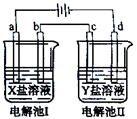
| 选项 | X | Y |
| A. | AgNO3 | Cu(NO3)2 |
| B. | MgSO4 | CuSO4 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g |
下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性。请根据图示判断下列有关说法不正确的是( )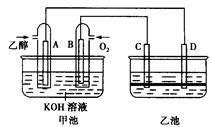
| A.甲池是原电池、乙池是电解池 |
| B.通入乙醇的惰性电极的电极反应式为:C2H5OH+16OH--12e-=2CO32-+11H2O |
| C.反应一段时间后,两池溶液的pH均未变化 |
| D.假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色 |
如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验: 断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
| A.断开K2,闭合K1一段时间,溶液的pH变大 |
| B.断开K1,闭合K2时,b极上的电极反应式为:2H++2e-====H2↑ |
| C.断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-====O2↑+2H2O |
| D.断开K1,闭合K2时,OH-向b极移动 |
锌片和碳棒用导线连接后插入稀硫酸中,锌片是
| A.阴极 | B.正极 | C.阳极 | D.负极 |