题目内容
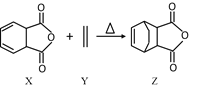
【题目】已知Diels-Alder 反应的原理:![]() 。化合物Z可通过如下反应制备:
。化合物Z可通过如下反应制备:
下列说法正确的是
A.化合物X中所有的碳原子共平面
B.化合物Z也可以用 ![]() 和
和 ![]() 来制备
来制备
C.1mol化合物Z可与3mol H2发生加成反应
D.化合物X的同分异构体中含有羧基的芳香族化合物有3种
【答案】B
【解析】
A、化合物X中有两个碳原子全部都是单键连接(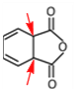 ),与这个两个碳原子相连的原子不可能共平面,故化合物X中所有碳原子不可能共平面,故A错误;
),与这个两个碳原子相连的原子不可能共平面,故化合物X中所有碳原子不可能共平面,故A错误;
B、由题干中制备Z的规律可知,![]() +
+ ![]()
![]()
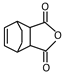 ,故B正确;
,故B正确;
C、Z中能与H2加成的只有碳碳双键,故1mol化合物Z可与1mol H2发生加成反应,故C错误;
D、化合物X的同分异构体中含有羧基的芳香族化合物有: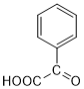 、
、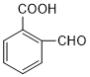 (邻间对共三种),一共4种,故D错误。
(邻间对共三种),一共4种,故D错误。

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
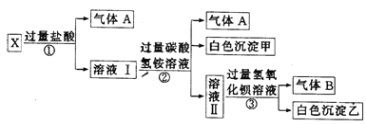
(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙![]() 粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______.
粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______.
(2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g),将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g)其相关数据如下表所示:
CO2(g)+2H2(g)其相关数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/mol | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 |
| 2 | 4 |
| 8 |
乙 | 1 |
| 1 | 2 |
| 3 |
①T1℃时,该反应的平衡常数 ______
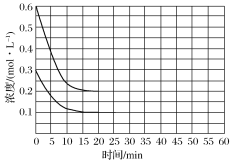
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 ____![]() 填选项字母
填选项字母![]() .
.
A、=0.8mol·L-1 B、=1.4mol·L-1 C、<1.4mol·L-1 D、>1.4mol·L-1
③丙容器的容积为1L,T2℃时,起始充入amolCO2(g)和bmolH2(g),反应达到平衡时,测得CO2的转化率大于![]() 的转化率,则
的转化率,则![]() 的值需满足的条件为 ______;
的值需满足的条件为 ______;
④丁容器的容积为1L,![]() 时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______
时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______![]() 填选项字母
填选项字母![]() .
.
A 0.6mol、1.0mol、0.5mol、1.0mol
B 0.6mol、2.0mol、0mol、0mol
C 1.0mol、2.0mol、1.0mol、2.0mol
D 0.25mol、0.5mol、0.75mol、1.5mol
(3)CO2在一定条件下可转化为甲醚CH3OCH3用甲醚燃料电池做电源,用惰性电极电解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如图所示
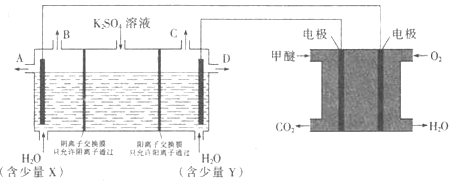
![]() 甲醚燃料电池的负极反应式为 ______
甲醚燃料电池的负极反应式为 ______
![]() 口导出的物质为 ______
口导出的物质为 ______![]() 填化学式
填化学式![]() .
.
![]() 若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C口收集到标准状况下气体的体积为 ______.
若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C口收集到标准状况下气体的体积为 ______.