题目内容
7.a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示.| a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 位于周期表中第4纵行 |
| e | 基态原子M层全充满,N层只有一个电子 |
(1)d属于d区的元素,其基态原子的价电子排布图为
 .
.(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种
 、
、 、
、 、
、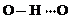 任意一种.
任意一种.(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp2杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为$\frac{M}{a{N}_{A}}$cm3(NA用表示阿伏加德罗常数的值).
分析 a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,a原子核外电子分占3个不同能级,且每个能级上排布的电子数相同,核外电子排布为1s22s22p2,故a为C元素;b元素基态原子的p轨道电子数比s轨道电子数少1,核外电子排布为1s22s22p3,故b为N元素;c在周期表所列元素中电负性最大,则c为F元素;d位于周期表中第4纵行,且处于第四周期,故d为Ti;e的基态原子M层全充满,N层只有一个电子,则核外电子数为2+8+18+1=29,故e为Cu,据此解答.
解答 解:a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,a原子核外电子分占3个不同能级,且每个能级上排布的电子数相同,核外电子排布为1s22s22p2,故a为C元素;b元素基态原子的p轨道电子数比s轨道电子数少1,核外电子排布为1s22s22p3,故b为N元素;c在周期表所列元素中电负性最大,则c为F元素;d位于周期表中第4纵行,且处于第四周期,故d为Ti;e的基态原子M层全充满,N层只有一个电子,则核外电子数为2+8+18+1=29,故e为Cu,
(l)d为Ti元素,属于d区的元素,基态原子的价电子排布3d24s2,故其基态原子的价电子排布图为 ,
,
故答案为:d; ;
;
(2)与b同周期相邻元素分别为C、O,同周期随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由大到小的顺序为:N>O>C,
故答案为:N>O>C;
(3)c的氢化物为HF,水溶液中存在的氢键有 、
、 、
、 、
、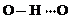 ,共4种,
,共4种,
故答案为:4; 、
、 、
、 、
、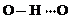 任意一种;
任意一种;
(4)a与其相邻同主族元素的最高价氧化物分别为CO2、SiO2,前者属于分子晶体,后者属于原子晶体,故熔点高低顺序为SiO2>CO2.a元素最高价氧化物水化物对应的正盐酸根离子为CO32-,离子中C原子价层电子对数=3+$\frac{4+2-2×3}{2}$=3,没有孤电子对,故碳酸根离子为平面三角形结构,中心C原子的轨道杂化类型为 sp2杂化;与CO32-互为等电子体的一种分子为SO3等,
故答案为:SiO2>CO2;平面三角形;sp2杂化;SO3;
(5)Cu与Au的合金可形成面心立方最密堆积的晶体,在晶胞中Cu原子处于面心,Au原子处于顶点,该晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,储氢后的 晶胞结构与金刚石晶胞结构相似,金刚石晶胞结构为 ,则形成的晶体中晶胞中原子为H原子,共有有4个,Cu原子数目为6×$\frac{1}{2}$=3,Au原子数目为8×$\frac{1}{8}$=1,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,晶胞质量为$\frac{M}{N{\;}_{A}}$g,晶体密度为ag/cm3,则晶胞的体积为$\frac{M}{N{\;}_{A}}$g÷ag/cm3=$\frac{M}{a{N}_{A}}$cm3,
,则形成的晶体中晶胞中原子为H原子,共有有4个,Cu原子数目为6×$\frac{1}{2}$=3,Au原子数目为8×$\frac{1}{8}$=1,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,晶胞质量为$\frac{M}{N{\;}_{A}}$g,晶体密度为ag/cm3,则晶胞的体积为$\frac{M}{N{\;}_{A}}$g÷ag/cm3=$\frac{M}{a{N}_{A}}$cm3,
故答案为:H4Cu3Au;$\frac{M}{a{N}_{A}}$cm3.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、氢键、晶体类型与性质、分子结构与性质、晶胞计算等,明确元素种类是解题关键,注意同周期元素第一电离能异常情况,注意利用均摊法进行晶胞的有关计算,难度中等.

| A. | 水 | B. | 碳酸钠溶液 | C. | 溴水 | D. | 汽油 |
 在2010年12月初农兴中学顺利接受省级示范高中验收期间,学校租用了大量盆栽鲜花装扮校园.为保证鲜花盛开,这些盆栽鲜花都施用了S-诱抗素剂,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
在2010年12月初农兴中学顺利接受省级示范高中验收期间,学校租用了大量盆栽鲜花装扮校园.为保证鲜花盛开,这些盆栽鲜花都施用了S-诱抗素剂,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A. | S-诱抗素含有苯环、羟基、羰基、羧基 | |
| B. | S-诱抗素能与NaHCO3反应放出CO2 | |
| C. | S-诱抗素的分子式为C14H20O4 | |
| D. | 1molS-诱抗素在一定条件下可分别与4molH2、2molNaOH发生反应 |
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥使用了合适的催化剂.
| A. | ①② | B. | ②③⑤ | C. | ⑤ | D. | ④⑥ |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是:CO (g)+H2O (g)?CO2 (g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应为平衡状态 | |
| D. | 某温度下,如果平衡浓度符合下列关系式:$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,判断此时的温度是1000℃ |
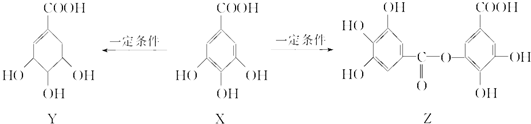
| A. | 1 mol X最多能与2 mol Br2发生取代反应 | |
| B. | Y分子结构中有3个手性碳原子 | |
| C. | 1 mol Z最多能与7 mol NaOH发生反应 | |
| D. | Y能发生加成、取代、消去、氧化、缩聚反应 |
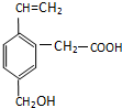
①可以燃烧
②能使酸性KMnO4溶液褪色
③能跟NaOH溶液反应
④能发生酯化反应
⑤能发生加成反应.
| A. | 只有②③④ | B. | 只有①②③④ | C. | ①②③④⑤ | D. | 只有②④ |
 ;乙分子的结构式
;乙分子的结构式 .
.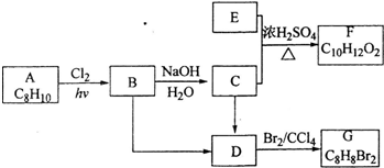

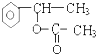 +H2O
+H2O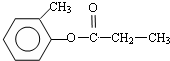 、
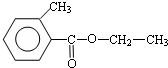
、
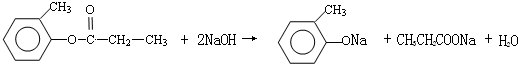 .
.