题目内容
7.已知下列数据:| 物 质 | 2,4,6 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |

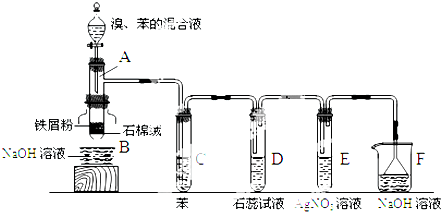
实验室制乙酸乙酯的主要装置如上图I所示,主要步骤为:
①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;
②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,
③小火加热试管中的混合液;
④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;
⑤分离出纯净的乙酸乙酯.
请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是先加乙酸和乙醇各4mL,再缓缓加入1mL浓H2SO4,边加边振荡.
(2)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓H2SO4的作用是催化剂、吸水剂.
(3)步骤③中,用小火加热试管中的混合液,其原因与结论乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失.
(4)步骤④所观察到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,原因是上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现.
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是分液漏斗,产物应从上口倒出,因为乙酸乙酯比水密度小.
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如图Ⅱ甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物).你认为哪种装置合理,为什么?
答:乙,反应物能冷凝回流.
分析 (1)乙酸、乙醇和浓硫酸混合时相当于浓硫酸稀释,所以应该将浓硫酸加入乙醇和乙酸的混合溶液中,并不断振荡;
(2)在浓硫酸作催化剂、加热条件下,乙酸和乙醇发生酯化反应生成乙酸乙酯;浓硫酸具有吸水性和催化能力;
(3)乙酸、乙醇、乙酸乙酯沸点接近且较低,温度高时三者都易挥发;
(4)乙酸乙酯是难溶于碳酸钠溶液的无色液体,碳酸钠溶液呈碱性,酚酞遇碱变红色,所以碳酸钠溶液呈红色,生成的乙酸乙酯中含有乙醇和乙酸,乙醇极易溶于水,乙酸和碳酸钠反应生成乙酸钠、二氧化碳和水,导致溶液碱性降低;
(5)分离互不相溶的液体采用分液方法,分液所用的仪器是分液漏斗;为防止分离出的液体中含有杂质;(6)甲、乙的区别是乙装置能冷凝回流.
解答 解:(1)乙酸、乙醇和浓硫酸混合时相当于浓硫酸稀释,所以应该将浓硫酸加入乙醇和乙酸的混合溶液中,并不断振荡,防止局部温度过高而产生安全事故,
故答案为:先加乙酸和乙醇各4mL,再缓缓加入1mL浓H2SO4,边加边振荡;
(2)在浓硫酸作催化剂、加热条件下,乙酸和乙醇发生酯化反应生成乙酸乙酯,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;浓硫酸具有吸水性和催化能力,所以该反应中浓硫酸作催化剂和吸水剂,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;催化剂、吸水剂;
(3)乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失,降低产率,所以用小火加热,
故答案为:乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失;
(4)乙酸乙酯是难溶于碳酸钠溶液的无色液体,碳酸钠溶液呈碱性,酚酞遇碱变红色,所以碳酸钠溶液呈红色,生成的乙酸乙酯中含有乙醇和乙酸,乙醇极易溶于水,乙酸和碳酸钠反应生成乙酸钠、二氧化碳和水,导致溶液碱性降低,所以看到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,
故答案为:在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄;上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现;
(5)分离互不相溶的液体采用分液方法,分液所用的仪器是分液漏斗,乙酸乙酯密度小于水,所以应该从上口倒出,
故答案为:分液漏斗;上;乙酸乙酯比水密度小;
(6)甲、乙的区别是乙装置能冷凝回流,提高产率,所以选乙,故答案为:乙,反应物能冷凝回流.
点评 本题考查物质制备,为高频考点,明确实验步骤及实验原理是解本题关键,侧重考查实验操作、实验分析能力,知道碳酸钠溶液作用,易错点是(6)题,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
请完成并配平上述化学方程式.其中氧化剂是K2Cr2O7,氧化产物是CO2
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H
下表所列数据是该反应在不同温度下的化学平衡常数(Κ).
| 温 度 | 250℃ | 300℃ | 350℃ |
| Κ | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为250℃.
③请在下列坐标中的画出②中求得温度下CO、H2和 CH30H的浓度随时间变化的曲线,并进行适当的标注.
(3)工业上也可以用CO2和H2反应制得甲醇.在2×105Pa、300℃的条件下,若有440g CO2与H2恰好完全反应生成甲醇和水,放出495kJ的热量,试写出该反应的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5KJ•mol-1.
(4)以CH3OH为燃料(以 KOH 溶液作电解质溶液)可制成CH3OH燃料电池,则充入CH3OH的电极为负极,充入O2电极的反应式为O2+4e-+2H2O=4OH-.
| A. | 两种溶液中的c(Na+)相等 | |
| B. | 分别加水稀释到100 mL时,两种溶液的pH依然相等 | |
| C. | 两溶液中由水电离出的c(OH-)之比为10-9/10-5 | |
| D. | 分别与同浓度的盐酸反应,pH=7时消耗的盐酸体积相等 |
 .
.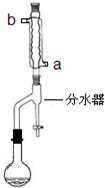 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.