题目内容
下列物质中,含有非极性共价键的是
| A.H2 | B.H2O | C.NaCl | D.NaOH |
A
解析试题分析:同种元素的原子之间形成的共价键是非极性共价键,不同种元素的原子之间形成的共价键是极性共价键。A.H-H键是非极性共价键。正确。B. H2O中的H-O键是极性共价键。正确。C.NaCl中Na+和Cl-是通过离子键结合的。错误。D.NaOH中Na+和OH-是通过离子键结合的。在OH-中H-O键是极性共价键。错误。
考点:考查化学键的种类。

练习册系列答案
相关题目
下列说法正确的是
| A.由分子组成的物质中一定存在共价键 |
| B.由非金属元素组成的化合物一定是共价化合物 |
| C.非极性键只能存在于双原子单质分子里 |
| D.两种非金属元素原子间不可能形成离子键 |
化学学习中,推理是一种重要的学习方法,下列推论正确的是( )
| A.由“BF3和SO3互为等电子体”,可推知二者均为非极性分子 |
| B.由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
| C.由“蒸干NaCl溶液得NaCl固体”,可推知蒸干MgCl2溶液得MgCl2固体 |
| D.由“同温度下等浓度的Na2CO3溶液比Na2SO3溶液的pH大”,可推知C比S的非金属性弱 |
把铜粉放入装有浓氨水的试管中,塞紧试管塞,振荡后发现试管塞越来越紧,且溶液逐渐变为浅黄色(近乎无色)溶液,打开试管塞后,溶液迅速变为蓝色溶液。则下列说法不正确的是 ( )
| A.试管塞越来越紧,是因为反应消耗了大量O2 |
| B.打开试管塞前Cu元素的化合价为+1价 |
C.溶液迅速变为蓝色溶液,是因为反应生成了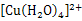 |
| D.上述反应原理可用于测定O2的含量 |
以下说法正确的是
| A.共价化合物内部可能有极性键和非极性键 |
| B.原子或离子间相互的吸引力叫化学键 |
| C.非金属元素间只能形成共价键 |
| D.金属元素与非金属元素的原子间只形成离子键 |
硫的卤化物(S2X2)是广泛用于橡胶工业的硫化剂,S2C12分子结构如图所示。遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是( )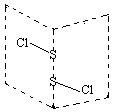
| A.稳定性S2C12>S2Br2 |
| B.反应中,生成1molSO2,转移电子为3mol |
| C.分子中同时含有极性键和非极性键且各原子都满足8电子稳定结构 |
| D.因为S-Cl键能比S-Br键能大,S2C12沸点比S2Br2高 |
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是 ( )
| A.氯化硼液态时能导电而固态时不导电 | B.氯化硼中心原子采用sp杂化 |
| C.氯化硼分子呈正三角形,属非极性分子 | D.其分子空间结构类似氯化磷 |
对P4S3分子的结构研究表明,该分子中不存在不饱和键,且各原子最外层均已达到8个电子稳定结构。则一个P4S3分子中含有的共价键个数为
| A.7个 | B.9个 | C.19个 | D.不能确定 |
下列有关化学键与晶体结构的说法正确的是
| A.两种元素组成的分子中一定只有极性键 |
| B.离子化合物的熔点一定比共价化合物的高 |
| C.非金属元素组成的化合物一定是共价化合物 |
| D.含有阴离子的化合物一定含有阳离子 |