题目内容
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液![]() 醋酸二氨合铜
醋酸二氨合铜![]() Ⅰ
Ⅰ![]() ,氨水
,氨水![]() 吸收在生产过程中产生的CO和
吸收在生产过程中产生的CO和![]() 等气体,铜液吸收CO的反应是放热反应,其反应方程式为:
等气体,铜液吸收CO的反应是放热反应,其反应方程式为:![]() ; 完成下列填空:
; 完成下列填空:
![]() 如果要提高上述反应的反应速率,可以采取的措施是 ______
如果要提高上述反应的反应速率,可以采取的措施是 ______ ![]() 选填编号
选填编号![]()
![]() 减压
减压 ![]() 增加
增加![]() 的浓度
的浓度 ![]() 升温
升温 ![]() 及时移走产物
及时移走产物
![]() 铜液中的氨可吸收二氧化碳,写出该反应的化学方程式: ______
铜液中的氨可吸收二氧化碳,写出该反应的化学方程式: ______
![]() 简述铜液吸收CO及铜液再生的操作步骤
简述铜液吸收CO及铜液再生的操作步骤![]() 注明吸收和再生的条件
注明吸收和再生的条件![]() .______
.______
![]() 铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为 ______ 通过比较 ______ 可判断氮、磷两种元素的非金属性强弱.
铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为 ______ 通过比较 ______ 可判断氮、磷两种元素的非金属性强弱.
![]() 已知
已知![]() 与
与![]() 分子结构相似,
分子结构相似,![]() 的电子式是 ______
的电子式是 ______ ![]() 熔点高于
熔点高于![]() ,其原因是 ______
,其原因是 ______
![]() 提取的
提取的![]() 中含少量
中含少量![]() 、
、![]() 将产品溶解,加入
将产品溶解,加入![]() ,加热至沸,再加入
,加热至沸,再加入![]() 溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是 ______
溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是 ______ ![]() 滤渣的主要成分是 ______ 、 ______ .
滤渣的主要成分是 ______ 、 ______ .
![]() 称取
称取![]() 小苏打样品
小苏打样品![]() 含少量
含少量![]() ,配置成250mL溶液,取
,配置成250mL溶液,取![]() 用
用![]() 盐酸滴定,消耗盐酸
盐酸滴定,消耗盐酸![]() 实验中所需的定量仪器出滴定管外,还有 ______
实验中所需的定量仪器出滴定管外,还有 ______ ![]() 选甲基橙而不选酚酞作为指示剂的原因是 ______
选甲基橙而不选酚酞作为指示剂的原因是 ______ ![]() 样品中
样品中![]() 质量分数为 ______
质量分数为 ______ ![]() 保留3位小数
保留3位小数![]()
![]() 将一定量小苏打样品
将一定量小苏打样品![]() 含少量
含少量![]() 溶于足量盐酸,蒸干后称量固体质量,也可测量定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果 ______
溶于足量盐酸,蒸干后称量固体质量,也可测量定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果 ______ ![]() 选填“偏高”、“偏低”或“不受影响”
选填“偏高”、“偏低”或“不受影响”![]()
【答案】bc ![]()
![]() 低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用
低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用 ![]()
![]() 者都为分子晶体,相对分子质量越大,分子间作用力越大;使亚铁离子快速氧化为三价铁离子,并使氯化铁充分水解,形成氢氧化铁沉淀
者都为分子晶体,相对分子质量越大,分子间作用力越大;使亚铁离子快速氧化为三价铁离子,并使氯化铁充分水解,形成氢氧化铁沉淀 ![]()
![]() 电子天平、250mL容量瓶 氢化物的稳定性 使用甲基橙易判断滴定终点,误差小
电子天平、250mL容量瓶 氢化物的稳定性 使用甲基橙易判断滴定终点,误差小 ![]() 偏高
偏高
【解析】
![]() 增大浓度、升高温度等,可增大反应速率;
增大浓度、升高温度等,可增大反应速率;
![]() 氨气、水、二氧化碳可反应生成碳酸铵或碳酸氢铵;
氨气、水、二氧化碳可反应生成碳酸铵或碳酸氢铵;
![]() 铜液吸收CO,应使平衡向正向移动,铜液再生,应使平衡向逆向移动;
铜液吸收CO,应使平衡向正向移动,铜液再生,应使平衡向逆向移动;
![]() 铜液的组成元素中,短周期元素有H、C、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小,比较非金属性强弱,可根据氢化物的稳定性强弱判断;
铜液的组成元素中,短周期元素有H、C、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小,比较非金属性强弱,可根据氢化物的稳定性强弱判断;
![]() 的电子式类似于
的电子式类似于![]() ,二者都为分子晶体,相对分子质量越大,熔点越高;
,二者都为分子晶体,相对分子质量越大,熔点越高;
![]() 加入
加入![]() ,氧化亚铁离子,再加入
,氧化亚铁离子,再加入![]() 溶液生成硫酸钡沉淀,加热至沸促进铁离子水解;
溶液生成硫酸钡沉淀,加热至沸促进铁离子水解;
![]() 实验中所需的定量仪器出滴定管外,需要锥形瓶等;小苏打溶液为弱碱性,与酚酞变色范围相近,不能判断滴定终点;配置成250mL溶液,取
实验中所需的定量仪器出滴定管外,需要锥形瓶等;小苏打溶液为弱碱性,与酚酞变色范围相近,不能判断滴定终点;配置成250mL溶液,取![]() 用
用![]() 盐酸滴定,消耗盐酸
盐酸滴定,消耗盐酸![]() ,碳酸氢钠的质量为
,碳酸氢钠的质量为![]() ;
;
![]() 蒸发过程中有少量液体溅出,蒸干后所得固体质量偏小,则小苏打含量偏高。
蒸发过程中有少量液体溅出,蒸干后所得固体质量偏小,则小苏打含量偏高。
![]() 增大浓度、升高温度等,可增大反应速率,减压反应速率减小,减小生成物浓度,反应速率减小,故答案为:bc;
增大浓度、升高温度等,可增大反应速率,减压反应速率减小,减小生成物浓度,反应速率减小,故答案为:bc;
![]() 氨气、水、二氧化碳可反应生成碳酸铵或碳酸氢铵,方程式为
氨气、水、二氧化碳可反应生成碳酸铵或碳酸氢铵,方程式为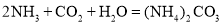 、
、![]() ,故答案为:
,故答案为:![]() 、
、![]() ;
;
![]() 正反应放热,铜液吸收CO,应使平衡向正向移动,则可在低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用,故答案为:低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用;
正反应放热,铜液吸收CO,应使平衡向正向移动,则可在低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用,故答案为:低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用;
![]() 铜液的组成元素中,短周期元素有H、C、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小,则原子半径
铜液的组成元素中,短周期元素有H、C、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小,则原子半径![]() ,可利用氢化物的稳定性
,可利用氢化物的稳定性![]() 同条件下硝酸与磷酸的酸性强弱
同条件下硝酸与磷酸的酸性强弱![]() 比较非金属性,故答案为:
比较非金属性,故答案为:![]() ;氢化物的稳定性;
;氢化物的稳定性;
![]() 的电子式类似于
的电子式类似于![]() ,电子式为
,电子式为![]() ,二者都为分子晶体,相对分子质量越大,分子间作用力越大,则熔点越高, 故答案为:
,二者都为分子晶体,相对分子质量越大,分子间作用力越大,则熔点越高, 故答案为:![]() ;二者都为分子晶体,相对分子质量越大,分子间作用力越大;
;二者都为分子晶体,相对分子质量越大,分子间作用力越大;
![]() 加热至沸的目的是使亚铁离子快速氧化为三价铁离子,并使氯化铁充分水解,形成氢氧化铁沉淀,滤渣的主要成分是
加热至沸的目的是使亚铁离子快速氧化为三价铁离子,并使氯化铁充分水解,形成氢氧化铁沉淀,滤渣的主要成分是![]() 或氢氧化铁
或氢氧化铁![]() 、
、![]() 或硫酸钡
或硫酸钡![]() ,故答案为:使亚铁离子快速氧化为三价铁离子,并使氯化铁充分水解,形成氢氧化铁沉淀;
,故答案为:使亚铁离子快速氧化为三价铁离子,并使氯化铁充分水解,形成氢氧化铁沉淀;![]() ;
;![]() ;
;
![]() 配成
配成![]() 溶液,用到的仪器有电子天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以所需的定量仪器除滴定管、电子天平外,还有250ml容量瓶; 碳酸氢钠溶液的
溶液,用到的仪器有电子天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以所需的定量仪器除滴定管、电子天平外,还有250ml容量瓶; 碳酸氢钠溶液的![]() 本来就接近
本来就接近![]() ,与酚酞变色的
,与酚酞变色的![]() 接近,变色时的
接近,变色时的![]() 和反应终点的
和反应终点的![]() 不好判断;而使用甲基橙容易判断终点,且反应产生的二氧化碳不能全部逸出使溶液偏酸性,因此使用甲基橙的误差小; 消耗盐酸的物质的量
不好判断;而使用甲基橙容易判断终点,且反应产生的二氧化碳不能全部逸出使溶液偏酸性,因此使用甲基橙的误差小; 消耗盐酸的物质的量![]() , 则25mL溶液中
, 则25mL溶液中![]() , 所以样品中
, 所以样品中![]() ,
, ![]() ,故答案为:电子天平、250mL容量瓶;使用甲基橙易判断滴定终点,误差小;
,故答案为:电子天平、250mL容量瓶;使用甲基橙易判断滴定终点,误差小;![]() ;
;
![]() 如全部为碳酸氢钠,与盐酸反应后生成氯化钠,质量减小,而如全部为氯化钠时,质量基本不变,可知加热后固体质量越小,碳酸氢钠含量越大,则若蒸发过程中有少量液体溅出,蒸干后所得固体质量偏小,则小苏打含量偏高,故答案为:偏高。
如全部为碳酸氢钠,与盐酸反应后生成氯化钠,质量减小,而如全部为氯化钠时,质量基本不变,可知加热后固体质量越小,碳酸氢钠含量越大,则若蒸发过程中有少量液体溅出,蒸干后所得固体质量偏小,则小苏打含量偏高,故答案为:偏高。