题目内容
【题目】分别用浓度均为![]() 的
的![]() 和NaOH溶液,滴定
和NaOH溶液,滴定![]() 溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是
溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是![]()
![]()
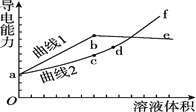
A.曲线2代表滴加![]() 溶液的变化曲线
溶液的变化曲线
B.b和d点对应的溶液均显碱性
C.b点溶液中![]()
D.![]() 段导电能力升高的原因是发生了反应
段导电能力升高的原因是发生了反应![]()
【答案】C
【解析】
![]() 溶液中离子浓度越大,导电性越强,分别用浓度均为
溶液中离子浓度越大,导电性越强,分别用浓度均为![]() 的
的![]() 和NaOH溶液滴定
和NaOH溶液滴定![]() 溶液,氨水滴入发生反应:
溶液,氨水滴入发生反应:![]() ,继续加入氨水后,溶液中离子浓度减小,导电性减弱,NaOH溶液滴入发生的反应为:
,继续加入氨水后,溶液中离子浓度减小,导电性减弱,NaOH溶液滴入发生的反应为:![]() ,
,![]() ,继续加入NaOH溶液,离子浓度增大导电性增强,所以曲线1代表滴加
,继续加入NaOH溶液,离子浓度增大导电性增强,所以曲线1代表滴加![]() 溶液的变化曲线,故A错误;
溶液的变化曲线,故A错误;
B.b点为硫酸铵溶液,铵根水解溶液显酸性,d点溶液中含Na2SO4、![]() ,偏铝酸根离子水解溶液显碱性,故B错误;
,偏铝酸根离子水解溶液显碱性,故B错误;
C.b点为硫酸铵溶液,铵根水解溶液显酸性,则溶液中离子浓度大小关系为![]() ,故C正确;
,故C正确;
D.d点溶液中含![]() ,d~f段以后氢氧化钠过量,溶液中离子浓度增大,导电性增强,故D错误;
,d~f段以后氢氧化钠过量,溶液中离子浓度增大,导电性增强,故D错误;
故选:C。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
【题目】在不同温度下,向 2 L密闭容器中加入1 mol NO(g)和1 mol活性炭(C),发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
温度/℃ | n(C)/mol | n(CO2)/mol |
t1 | 0.70 | |
t2 | 0.25 |
下列说法不正确的是( )
A.上述信息可推知:t1<t2
B.t1℃ 时,该反应的平衡常数K=![]()
C.t2℃ 时,若反应达平衡后再缩小容器的容积,c(N2)∶c(NO)不变
D.t1℃ 时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小