题目内容
11.下列溶液中有关物质的量浓度关系正确的是( )| A. | 0.1mol/L pH=3的H2A溶液与0.01mol pH=11的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A2-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
分析 A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液,NaOH是强碱,溶液的浓度最小;酸根离子水解程度越大相同pH的钠盐溶液浓度越小;
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
D.0.1mol•L-1的NaHA溶液,其pH=4,说明HA-的电离程度大于水解程度而导致溶液呈酸性,但电离和水解程度都较小.
解答 解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(M+)=c(OH-)+2c(A2-)+c(HA-),故A错误;
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液,NaOH是强碱,溶液的浓度最小;酸根离子水解程度越大相同pH的钠盐溶液浓度越小,水解程度CO32->CH3COO-,所以c(CH3COONa)>c(Na2CO3),所以三种溶液浓度c(NaOH)<c(Na2CO3)<c(CH3COONa),故B错误;
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液中存在电荷守恒、物料守恒,根据电荷守恒得(CH3COO-)+c(OH-)=c(H+)+c(Na+),根据物料守恒得(CH3COO-)+c(CH3COOH)=2c(Na+),所以得c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),故C正确;
D.0.1mol•L-1的NaHA溶液,其pH=4,说明HA-的电离程度大于水解程度而导致溶液呈酸性,但电离和水解程度都较小,所以离子浓度大小顺序是c(HA-)>c(H+)>c(A2-)>c(H2A),故D错误;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质再结合溶液酸碱性分析解答,注意守恒思想的灵活运用,遵循电荷守恒和物料守恒,题目难度不大.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案| A. | 钠和水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 铜跟稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| C. | 向AlCl3溶液中加入过量的氨水溶液:Al3++3OH-=Al(OH)3↓ | |
| D. | 氯气通入冷的氢氧化钠溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O |
回答下列问题:
下表为反应物A浓度与反应时间的数据,计算:a=0.051.
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol•L-1) | 0.10 | a | 0.026 | 0.0065 |
| A. | 转移电子的数目为0.2NA | B. | 所得溶液中溶质的质量分数为2.3% | ||
| C. | 产生气体的体积为1.12L | D. | 产生的气体含有0.1mol电子 |
| A. |  实验室制氯气 实验室制氯气 | B. | 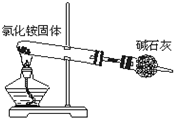 氨气的制取 氨气的制取 | ||
| C. | 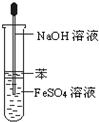 Fe(OH)2的制取 Fe(OH)2的制取 | D. |  浓硫酸的稀释 浓硫酸的稀释 |
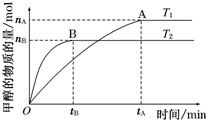 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题: