题目内容
16.将2.3g钠放人97.7g水中,下列说法正确的是(用NA表示阿伏加德罗常数的值)( )| A. | 转移电子的数目为0.2NA | B. | 所得溶液中溶质的质量分数为2.3% | ||
| C. | 产生气体的体积为1.12L | D. | 产生的气体含有0.1mol电子 |
分析 n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,钠和水反应方程式为2Na+2H2O=2NaOH+H2↑,根据方程式知,溶液质量增加量=2.3g-$\frac{0.1mol×1}{2}×2g/mol$=2.2g,所以溶液质量=97.7g+2.2g=99.9g,
A.每个钠原子失去一个电子,根据钠和转移电子之间关系式计算转移电子数;
B.根据钠原子守恒得n(NaOH)=n(Na)=0.1mol,m(NaOH)=0.1mol×40g/mol=4g,溶液质量分数=$\frac{溶质的质量}{溶液的质量}×100%$;
C.根据转移电子守恒知,生成氢气物质的量=$\frac{0.1mol×1}{2}$=0.05mol,根据V=nVm计算气体体积;
D.根据C知,生成氢气物质的量是0.05mol,每个氢气分子含有2个电子,计算计算生成氢气中含有电子物质的量.
解答 解:n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,钠和水反应方程式为2Na+2H2O=2NaOH+H2↑,根据方程式知,溶液质量增加量=2.3g-$\frac{0.1mol×1}{2}×2g/mol$=2.2g,所以溶液质量=97.7g+2.2g=99.9g,
A.每个钠原子失去一个电子,根据钠和转移电子之间关系式知,转移电子数为0.1NA,故A错误;
B.根据钠原子守恒得n(NaOH)=n(Na)=0.1mol,m(NaOH)=0.1mol×40g/mol=4g,溶液质量分数=$\frac{溶质的质量}{溶液的质量}×100%$=$\frac{4g}{99.9g}×100%$>4%,故B错误;
C.根据转移电子守恒知,生成氢气物质的量=$\frac{0.1mol×1}{2}$=0.05mol,温度和压强未知,导致气体摩尔体积未知,所以无法计算气体体积,故C错误;
D.根据C知,生成氢气物质的量是0.05mol,每个氢气分子含有2个电子,则生成氢气中含有电子物质的量=0.05mol×2=0.1mol,故D正确;
故选D.
点评 本题考查化学方程式的有关计算,为高频考点,明确各个物理量关系是解本题关键,易错选项是C,注意气体摩尔体积适用范围及适用条件,题目难度不大.

| A. | N2O4属于离子化合物 | B. | X的离子符号为N2O+ | ||
| C. | Y的离子符号为NO2- | D. | 铜与液体N2O4反应会生成NO气体 |
| A. | 0.1mol/L pH=3的H2A溶液与0.01mol pH=11的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A2-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
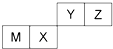
| A. | 元素形成的简单离子的半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X 的强 | |
| C. | X 的最简单气态氢化物的热稳定性比Z的小 | |
| D. | Z位于元素周期表中第2 周期、第ⅥA族 |
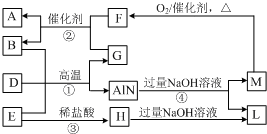 AlN是一种新型高温结构陶瓷,工业上可用图中的反应①制备,反应②常用于处理汽车尾气.B、D是单质,A、E、F、G是氧化物,A是形成温室效应的气体,M能使湿润的红色石蕊试纸变蓝的气体(转化过程中的部分产物已略去).
AlN是一种新型高温结构陶瓷,工业上可用图中的反应①制备,反应②常用于处理汽车尾气.B、D是单质,A、E、F、G是氧化物,A是形成温室效应的气体,M能使湿润的红色石蕊试纸变蓝的气体(转化过程中的部分产物已略去). .
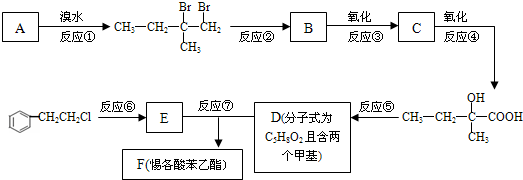
. 
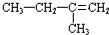 ,其名称为2-甲基-1-丁烯;
,其名称为2-甲基-1-丁烯; +
+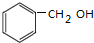 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$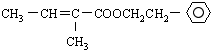 +H2O;
+H2O;