题目内容
在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,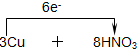 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O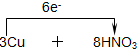 =3Cu(NO3)2+2NO↑+4H2O.
=3Cu(NO3)2+2NO↑+4H2O.
HNO3
HNO3
是氧化剂;Cu
Cu
是还原剂;铜
铜
元素被氧化;氮
氮
元素被还原;被还原的HNO3与参加反应的HNO3物质的量之比是1:4
1:4
.用单线桥表示反应过程中转移电子的方向和数目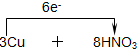 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O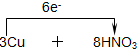 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O分析:在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,氧化剂被还原,还原剂被氧化,根据硝酸中N元素的化合价是否变化来确定被还原的HNO3与参加反应的HNO3物质的量之比,并用单线桥法标出电子转移的方向和数目,注意单线桥中由失去电子的物质指向得电子的物质.
解答:解:在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,硝酸得电子作氧化剂,硝酸中N元素得电子被还原,铜 作还原剂,铜元素被氧化,如果有8mol硝酸参加反应,则有2mol硝酸参加氧化还原反应,所以被还原的HNO3与参加反应的HNO3物质的量之比是2:8=1:4,该反应中转移电子数=3(2-0)=2(5-2)=6,所以用单线桥表示反应过程中转移电子的方向和数目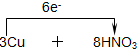 =3Cu(NO3)2+2NO↑+4H2O,
=3Cu(NO3)2+2NO↑+4H2O,
故答案为:HNO3;Cu;铜;氮;1:4;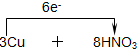 =3Cu(NO3)2+2NO↑+4H2O.
=3Cu(NO3)2+2NO↑+4H2O.
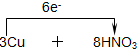 =3Cu(NO3)2+2NO↑+4H2O,
=3Cu(NO3)2+2NO↑+4H2O,故答案为:HNO3;Cu;铜;氮;1:4;
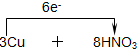 =3Cu(NO3)2+2NO↑+4H2O.
=3Cu(NO3)2+2NO↑+4H2O.点评:本题考查氧化还原反应,明确氧化剂和还原剂的区别,难点是单线桥的运用.

练习册系列答案
相关题目
