题目内容
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx,挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H=+67.0 kJ·mol-1
2NO2(g)△H=+67.0 kJ·mol-1
③H2O(g)=H2O(l)△H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)△H=_____kJ·mol-1;
CO2(g)+2H2O(g)+N2(g)△H=_____kJ·mol-1;
(2)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
① a表示_____离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品。其中C为硫酸,则A表示_______。
②阳极的电极反应式为____________________。
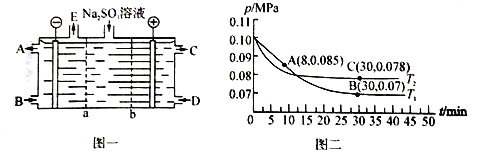
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g) ![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率v0(正)与A点的逆反应速率vA(逆)的大小关系为v0(正)_____vA(逆) (填“>"、“<”或“ = ”)。
③图中B点的压强平衡常数Kp=______。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为______________。
【答案】 -875.3 阳 NaOH溶液 SO32--2e-+H2O=2H++SO42- 45% > 24300(MPa)-1 ![]() mol·L-1
mol·L-1
【解析】(1)①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ·mol-1,②N2(g)+2O2(g)![]() 2NO2(g)△H=+67.0 kJ·mol-1,③H2O(g)=H2O(l)△H=-41.0 kJ·mol-1,根据盖斯定律,将①-②-③×2得:CH4(g)+2NO2(g)
2NO2(g)△H=+67.0 kJ·mol-1,③H2O(g)=H2O(l)△H=-41.0 kJ·mol-1,根据盖斯定律,将①-②-③×2得:CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)△H=(-890.3 kJ·mol-1)-(+67.0 kJ·mol-1)-(-41.0 kJ·mol-1)×2=-875.3kJ·mol-1,故答案为:-875.3;
CO2(g)+2H2O(g)+N2(g)△H=(-890.3 kJ·mol-1)-(+67.0 kJ·mol-1)-(-41.0 kJ·mol-1)×2=-875.3kJ·mol-1,故答案为:-875.3;
(2) ①从C为硫酸可知,硫酸根来源于亚硫酸根放电.故b为阴离子交换膜,a为阳离子交换膜,在阴极区应为水放电生成氢气和氢氧根离子,故A为氢氧化钠,E为氢气,故答案为:阳;NaOH溶液;
②阳极应为亚硫酸根放电生成硫酸根,反应的离子方程式为SO32--2e-+H2O=2H++SO42-,故答案为:SO32--2e-+H2O=2H++SO42- ;
(3) ①设氧气消耗物质的量为x,
2SO2(g)+O2(g)2SO3(g)
起始量(mol) 2a a 0
变化量(mol) 2x x 2x
平衡量(mol)2a-2xa-x2x
图中A点时,气体物质的量0.085,则![]() =
=![]() ,x=0.45a
,x=0.45a
SO2的转化率=![]() ×100%=45%,故答案为:45%;
×100%=45%,故答案为:45%;
②图象分析可知,先拐先平温度高则T1<T2,C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率v0(正)与A点的逆反应速率vA(逆)的大小关系为v0(正)>vA(逆), 故答案为:>;
③设图中B点氧气消耗物质的量为y,
2SO2(g)+O2(g)2SO3(g)
起始量(mol) 2a a 0
变化量(mol) 2y y 2y
平衡量(mol)2a-2y a-y 2y
B点气体物质的量为 0.007,则![]() =
=![]() ,y=0.9a,
,y=0.9a,
平衡常数K=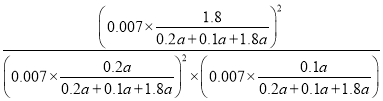 =24300(MPa)-1,故答案为:24300(MPa)-1;
=24300(MPa)-1,故答案为:24300(MPa)-1;
(4)反应生成物有NaNO3、NaNO2,由化学式可知n(Na)=n(N),根据原子守恒可知n(NaOH)=n(NO)+n(NO2)+2n(N2O4)=(a+b+2c)mol,故此氢氧化钠溶液的物质的量浓度最小为![]() =
=![]() molL-1,故答案为:
molL-1,故答案为: ![]() molL-1。
molL-1。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案