题目内容
用铂作电极,KOH溶液作电解质溶液,分别向两极通入CH4和O2,即产生电流,称为甲烷燃料电池.已知甲烷燃料电池的总反应为CH4+2O2+2OH-═CO32-+3H2O,下列有关说法中错误的是( )
| A、CH4在负极上反应 |
| B、放电过程中电解质溶液的碱性不变 |
| C、此电池属于环境友好电池 |
| D、可判断正极反应式为:2O2+8e-+4H2O═8OH- |
考点:化学电源新型电池
专题:电化学专题
分析:甲烷燃料电池中,负极上燃料失电子发生氧化反应,电极反应为CH4-8e-+10OH-═CO32-+7H2O,正极上通入氧化剂,电极反应为2O2+8e-+4H2O═8OH-,反应过程中氢氧根离子参加反应,导致溶液中氢氧根离子浓度减小,据此分析解答.
解答:
解:A.甲烷燃料电池中,燃料失电子发生氧化反应,所以CH4在负极上反应,故A正确;
B.根据CH4+2O2+2OH-═CO32-+3H2O知,氢氧根离子参加反应,所以溶液中氢氧根离子浓度降低,溶液的碱性减弱,故B错误;
C.该电池放电时不产生对环境有污染的物质,所以属于环境友好电池,故C正确;
D.正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:2O2+8e-+4H2O═8OH-,故D正确;
故选B.
B.根据CH4+2O2+2OH-═CO32-+3H2O知,氢氧根离子参加反应,所以溶液中氢氧根离子浓度降低,溶液的碱性减弱,故B错误;
C.该电池放电时不产生对环境有污染的物质,所以属于环境友好电池,故C正确;
D.正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:2O2+8e-+4H2O═8OH-,故D正确;
故选B.
点评:本题考查了化学电源新型电池,根据得失电子确定正负极上通入的物质及发生的反应,难点是电极反应式的书写,要结合溶液酸碱性书写,为易错点.

练习册系列答案
相关题目
在密闭容器中进行反应:X2(g)+3Y2(g)?2Z(g),其中X2、Y2、Z的起始浓度分别为0.1mol?L-1、0.3mol?L-1、0.2mol?L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、c(Z)=0.5 mol?L-1 |
| B、c(Y2)=0.5 mol?L-1 |
| C、c(X2)=0.2 mol?L-1 |
| D、c(Y2)=0.6 mol?L-1 |
不能用排水集气法收集的气体是( )
| A、H2 |
| B、NO |
| C、02 |
| D、HCl |
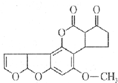 前不久,各大媒体在显著的位置刊登了关于900t致癌大米的报道,主要是变质大米中存在的黄曲霉素使人体中的特殊基因发生突变,有转变成肝癌的可能性.它的结构如图所示,和l mol该化合物起反应的H2或NaOH的最大值分别是( )
前不久,各大媒体在显著的位置刊登了关于900t致癌大米的报道,主要是变质大米中存在的黄曲霉素使人体中的特殊基因发生突变,有转变成肝癌的可能性.它的结构如图所示,和l mol该化合物起反应的H2或NaOH的最大值分别是( )| A、5mol,2mol |
| B、7mol,2mol |
| C、6mol,1mol |
| D、7mol,1mol |
根据元素周期律特点,Na、Mg、Al三种元素从左到右描述正确的是( )
| A、金属性依次增强 |
| B、最外层电子数依次增多 |
| C、原子半径依次增大 |
| D、最高正价依次减小 |
下列关于粒子结构的描述不正确的是( )
| A、NF3和BF3是中心原子杂化类型相同的极性分子 |
| B、CH2Cl2和C2H4是空间构型不同的非极性分子 |
| C、在SiO2晶体中,Si原子与Si-O键数目比为1:2 |
| D、CF4和CO2是含极性键的非极性分子 |
溴水中存在着如下的平衡:Br2+H2O?HBr+HBrO,下列措施,不能使溶液颜色变浅的是( )
| A、通入乙烯气体 |
| B、通入SO2气体 |
| C、加入NaF晶体 |
| D、加入NaI晶体 |
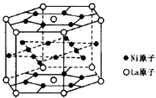 氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气.有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示,则这种合金的化学式为( )
氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气.有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示,则这种合金的化学式为( )| A、LaNi6 |
| B、LaNi3 |
| C、LaNi4 |
| D、LaNi5 |
自来水可以用氯气消毒.如果实验室中临时没有蒸馏水,可以用自来水配制某些急需的药品,但有些药品若用自来水配制,则明显导致药品变质.下列哪些药品不能用自来水配制( )
| A、FeCl2 |
| B、NaCl |
| C、AgNO3 |
| D、Na2SO4 |