题目内容
在密闭容器中进行反应:X2(g)+3Y2(g)?2Z(g),其中X2、Y2、Z的起始浓度分别为0.1mol?L-1、0.3mol?L-1、0.2mol?L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、c(Z)=0.5 mol?L-1 |
| B、c(Y2)=0.5 mol?L-1 |
| C、c(X2)=0.2 mol?L-1 |
| D、c(Y2)=0.6 mol?L-1 |
考点:化学反应的可逆性,化学平衡的计算
专题:化学平衡专题
分析:化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答:
解:若反应向正反应进行,假定完全反应,则:
X2(g)+3Y2(g)?2Z(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0 0 0.4
若反应逆反应进行,假定完全反应,则:
X2(g)+3Y2(g)?2Z(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0.2 0.6 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0<c(Y2)<0.6,0<c(Z)<0.4,故B正确、ACD错误;
故选:B.
X2(g)+3Y2(g)?2Z(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0 0 0.4
若反应逆反应进行,假定完全反应,则:
X2(g)+3Y2(g)?2Z(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0.2 0.6 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0<c(Y2)<0.6,0<c(Z)<0.4,故B正确、ACD错误;
故选:B.
点评:本题考查化学平衡的建立,关键是利用可逆反应的不完全性,运用极限假设法解答,难度不大.

练习册系列答案
相关题目
化学科学需要借助化学专用术语来描述,下列有关化学用语的使用正确的是( )
A、NH4Cl的电子式: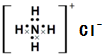 | ||
B、S2-的结构示意图: | ||
| C、CO2的结构式:O=C=O | ||
D、质量数为37的氯原子
|
某有机物分子式为C9H10O2①属于芳香族化合物;②能水解;③苯环上只有一个取代基.满足上述条件的同分异构体有( )
| A、4种 | B、6种 |
| C、18种 | D、20种 |
下列微粒的结构示意图中氧离子结构示意图的是( )
A、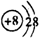 |
B、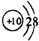 |
C、 |
D、 |
盛有CH4和空气的混和气的试管,其中CH4占
体积.在密闭条件下,用电火花点燃,冷却后倒置在盛满水的水槽中(去掉试管塞)此时试管中( )
| 1 |
| 5 |
A、水面上升到试管的
| ||
| B、水面上升到试管的一半以上 | ||
| C、水面无变化 | ||
| D、水面上升 |
下列有机物的命名正确的是( )
| A、3,3-二甲基丁烷 |
| B、3-甲基-2-乙基戊烷 |
| C、2,3-二甲基-1-戊烯 |
| D、2-甲基-1-戊炔 |
根据元素周期律和元素周期表的知识分析下面的推断,其中错误的是( )
| A、铍(Be)的氧化物及氢氧化物可能具有两性 |
| B、砹(At)的单质是有色固体,HAt很不稳定 |
| C、H2Se是无色、有毒的气体 |
| D、Sr(OH)2的碱性强于Ba(OH)2 |
用铂作电极,KOH溶液作电解质溶液,分别向两极通入CH4和O2,即产生电流,称为甲烷燃料电池.已知甲烷燃料电池的总反应为CH4+2O2+2OH-═CO32-+3H2O,下列有关说法中错误的是( )
| A、CH4在负极上反应 |
| B、放电过程中电解质溶液的碱性不变 |
| C、此电池属于环境友好电池 |
| D、可判断正极反应式为:2O2+8e-+4H2O═8OH- |