题目内容
13.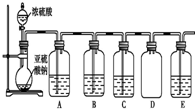 (1)某化学探究小组欲对SO2的化学性质进行如下探究,请你帮助他完成实验报告.
(1)某化学探究小组欲对SO2的化学性质进行如下探究,请你帮助他完成实验报告.| 物质 | 类别 | 化学性 质预测 | 实验验证 | ||
| 实验操作 | 实验现象 | 实质(用离子 方程式表示) | |||
| 二氧 化硫 | 酸性 氧化物 | 与水 反应 | 将盛满SO2气体的试管倒立在水中,并测定试管中溶液的pH | ① | SO2+H2O ?H2SO3 |
| 与碱 反应 | ② | 出现白 色沉淀 | ③ | ||
①请你完成下列表格.
| 装置 | 药品 | 作用 |
| A | 验证二氧化硫的还原性 | |
| B | ||
| C | 品红溶液 |
③实验时C中的实验现象是品红溶液褪色.
④D装置的作用是防倒吸.E是尾气处理装置,有人认为E装置中可以加入足量的Ba(NO3)2溶液,你认为是否合理,请结合离子方程式加以说明:不合理,因为发生的反应为3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO↑+4H+,生成的NO仍然对环境有污染.
分析 (1)①二氧化硫溶于水且和水反应生成亚硫酸,导致试管内气体的压强变小,试管中水面上升;亚硫酸是酸,所以其水溶液的PH小于7;
②验证二氧化硫与碱反应时,由于题目要求“出现白色沉淀”,因此不能用NaOH、KOH等碱溶液,必须用Ba(OH)2或Ca(OH)2等碱溶液;
③二氧化硫和Ba(OH)2或Ca(OH)2等碱溶液反应生成CaSO3或BaSO3沉淀;
(2)二氧化硫中硫元素的化合价是+4价,属于中间价态,预测其既有氧化性又有还原性,和氧化剂反应表现为还原性;和还原剂反应表现为氧化性;根据所提供的药品,验证二氧化硫的还原性,可选择具有强氧化性的酸性高锰酸钾溶液.品红溶液显然是验证二氧化硫的漂白性,现象是品红溶液褪色.具有还原性的Na2S判断SO2具有氧化性.二氧化硫的水溶液呈酸性,在酸性环境中NO3-可将溶液中+4价的S氧化为SO42-并生成BaSO4沉淀,同时NO3-被还原为NO,带来新的污染.
解答 解:(1)①二氧化硫在水中的溶解度较大,且二氧化硫和水反应生成亚硫酸,导致试管内气体的压强变小,试管中水面上升;亚硫酸是酸,所以其水溶液的PH小于7;
②验证二氧化硫与碱反应时,由于题目要求“出现白色沉淀”,因此不能用NaOH、KOH等碱溶液,必须用Ba(OH)2或Ca(OH)2等碱溶液;
③将SO2气体通入澄清石灰水中;SO2+Ca2++2OH-=CaSO3↓+H2O,将SO2气体通入Ba(OH)2中;SO2+Ba2++2OH-=BaSO3↓+H2O,
故答案为:①试管中液面上升,溶液pH<7;②将二氧化硫气体通入足量澄清石灰水[或Ba(OH)2溶液]中;③SO2+Ca2++2OH-=CaSO3↓+H2O(或SO2+Ba2++2OH-=BaSO3↓+H2O);
(2)①二氧化硫中硫元素的化合价是+4价,属于中间价态,预测其既有氧化性又有还原性,高锰酸钾有强氧化性,如果二氧化硫能使高锰酸钾褪色,验证二氧化硫有还原性,硫化钠有还原性,如果二氧化硫和硫化钠反应,验证二氧化硫有氧化性,二氧化硫能使品红溶液褪色,验证二氧化硫的漂白性,
故答案为:
| 装置 | 药品 | 作用 |
| A | 酸性高锰酸钾溶液 | |
| B | Na2S溶液 | 验证二氧化硫的氧化性 |
| C | 验证二氧化硫的漂白性 |
故答案为:5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+;
③通入SO2气体,品红溶液褪色,故答案为:品红溶液褪色;
④D两端都是短管,所以能防倒吸;E是尾气处理装置,有人认为E装置中可以加入足量的Ba(NO3)2溶液,3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO↑+4H+,生成的NO仍然对环境有污染,起不到尾气处理作用,所以不合理,
故答案为:防倒吸;不合理,因为发生的反应为3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO↑+4H+,生成的NO仍然对环境有污染.
点评 本题主要考查了探究SO2的化学性质实验操作,掌握实验的原理及二氧化硫的性质是解题的关键,题目难度中等.

| A. | 0.6mol H2SO4 | B. | 3.612×1023个HNO3分子 | ||
| C. | 7.3g HCl | D. | 4.48L CH4 |
| A. | 2Cu+O2═2 CuO | B. | CaO+H2O═Ca(OH)2 | ||
| C. | 2KMnO4═K2MnO4+MnO2+O2↑ | D. | 2Na+2H2O═2NaOH+H2↑ |
| A. | 2:1 | B. | 1:1 | C. | 4:1 | D. | 3:2 |
| A. | 干燥的氯气 | B. | 久置的氯水 | C. | 液氯 | D. | 次氯酸溶液 |
| A. | 4:5:2 | B. | 2:5:4 | C. | 1:3:2 | D. | 2:3:1 |
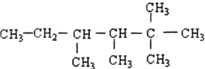 是由某单烯烃与H2加成后的产物,不考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )
是由某单烯烃与H2加成后的产物,不考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
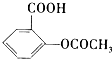 )是常用的解热镇痛药.它遇水会缓慢地水解生成水杨酸,则水杨酸的结构简式可表示为
)是常用的解热镇痛药.它遇水会缓慢地水解生成水杨酸,则水杨酸的结构简式可表示为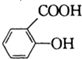 .
.
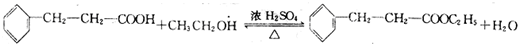 .
.
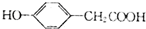 .
.