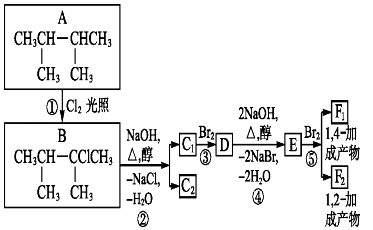
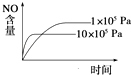��Ŀ����
����Ŀ����ѧ��Ӧ�е��ʱ䣨�� H���뷴Ӧ���������ļ��ܣ�E���йء��±�������һЩ��ѧ���ļ��ܣ�
��ѧ�� | H-H | N��N | O=O | O-H | N-H |
����(kJ/mol) | 436 | 942 | 500 | 463 | a |
��֪��ҵ�ϳɰ��� N2(g)+3H2(g)![]() 2NH3(g) �� H= -92.4 kJ�� mol-1�� ��ش��������⣺
2NH3(g) �� H= -92.4 kJ�� mol-1�� ��ش��������⣺
��1������ a = ______ kJ�� mol-1
��2��1 mol N2�� 3 mol H2��ַ�Ӧ���ų�������______92.4 kJ�����������������������
II���������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ����� CO2�ĺ�������Ч�ؿ�������CO2���������ձ�����ӡ�
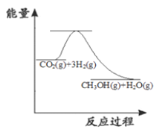
��1��Ŀǰ��ҵ����һ�ַ������� CO2�������״���CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)����ͼ��ʾ�÷�Ӧ���й����������ı仯���÷�Ӧ��_____������ȡ����ȡ�����Ӧ��
CH3OH(g)+H2O(g)����ͼ��ʾ�÷�Ӧ���й����������ı仯���÷�Ӧ��_____������ȡ����ȡ�����Ӧ��
��2�����и����У���˵�� CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)�Ѵﵽƽ�����____����ѡ���
CH3OH(g)+H2O(g)�Ѵﵽƽ�����____����ѡ���
A�����¡����������£������ڵ�ѹǿ�������仯
B��һ�������£�CH3OH �ֽ�����ʺ� CH3OH ���ɵ��������
C��һ�������£���λʱ�������� 1 mol CO2��ͬʱ���� 1 mol CH3OH
D��һ�������£�H2O(g)��Ũ�ȱ��ֲ���
���𰸡� 390.4 �� ���� ABD
����������1��������H����Ӧ��Ļ�ѧ���������յ�������������Ļ�ѧ���γ��ͷŵ��������㡣
��2�����ݿ��淴Ӧ���ܽ��е������
II����1������ͼ���з�Ӧ��������������������������Դ�С���
��2����һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬��
��1����֪��ҵ�ϳɰ���N2(g)+3H2(g)![]() 2NH3(g)��H=-92.4 kJ��mol-1���������H����Ӧ��Ļ�ѧ���������յ�������������Ļ�ѧ���γ��ͷŵ�������֪436��3+942��2��3��a����92.4�����a=390.4��
2NH3(g)��H=-92.4 kJ��mol-1���������H����Ӧ��Ļ�ѧ���������յ�������������Ļ�ѧ���γ��ͷŵ�������֪436��3+942��2��3��a����92.4�����a=390.4��
��2�����ںϳɰ��ķ�Ӧ�ǿ��淴Ӧ��1 mol N2�� 3 mol H2��ַ�Ӧ��������2mol��������˷ų���������92.4 kJ��
II����1������ͼ���֪��Ӧ����������������������������˸÷�Ӧ�Ƿ��ȷ�Ӧ��
��2��A������Ӧ�����С�����¡����������£������ڵ�ѹǿ�������仯˵����Ӧ�ﵽƽ��״̬��A��ȷ��B��һ�������£�CH3OH�ֽ�����ʺ�CH3OH���ɵ���������������淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬��B��ȷ��C��һ�������£���λʱ��������1 mol CO2��ͬʱ����1 mol CH3OH����ʾ����Ӧ���ʣ�����˵����Ӧ�ﵽƽ��״̬��C������D��һ�������£�H2O(g)��Ũ�ȱ��ֲ���˵�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬��D��ȷ����ѡABD��

����Ŀ��Na2S2O3��Һ��ϡH2SO4��Ӧ�Ļ�ѧ����ʽΪNa2S2O3+H2SO4=Na2SO4+SO2��+S��+H2O�����и���ʵ���У���Һ�����ȱ���ǵ��ǣ� ��
��Ӧ �¶� (��) | ��Ӧ�� | H2O | ||||
Na2S2O3 | H2SO4 | V(mL) | ||||
V(mL) | c(mol��L-1) | V(mL) | c(mol��L-1) | |||
A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
A.AB.BC.CD.D