题目内容
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
I.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变血红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是____________。
(4)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为__________________________;
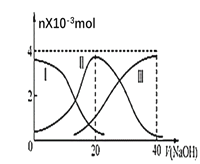
II.有部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理,回答下列问题:

(1)滤液A中含有主要的金属阳离子为:_________。
(2)原样品中氧元素的质量为__________。
【答案】防止Fe2+ 被氧化 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 隔绝空气(或排除氧气对实验的影响) 2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O Fe2+ 0.32g
【解析】
I.(1)配制0.1mol·L-1 的FeCl2溶液时,加入少量的铁屑可防止亚铁离子被氧化;
(2)根据实验现象,氯气与亚铁离子反应生成铁离子和氯离子;
(3)煤油的密度比水小,能够隔绝溶液与空气的接触;
(4)过氧化氢在酸性条件下与亚铁离子反应生成铁离子和水;
II.(1)根据流程,加入足量稀硫酸时,有固体剩余,则溶液中一定不含铁离子;
(2)根据质量守恒计算。
I.(1)配制0.1mol·L-1 的FeCl2溶液时,加入少量的铁屑可防止亚铁离子被氧化;
(2)根据实验现象,氯气与亚铁离子反应生成铁离子和氯离子,离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(3)煤油的密度比水小,能够隔绝溶液与空气的接触,防止空气中的氧气的干扰;
(4)过氧化氢在酸性条件下与亚铁离子反应生成铁离子和水,离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O;
II.(1)根据流程,加入足量稀硫酸时,有固体剩余,则溶液中一定不含铁离子,已知滤液A中无铜离子,则溶液中的主要金属阳离子为Fe2+;
(2)固体3.2g为氧化铁,则Fe元素的质量为![]() ×2×56=2.24g,铜的质量为3.2g,氧元素的质量=5.76-2.24-3.2=0.32g。
×2×56=2.24g,铜的质量为3.2g,氧元素的质量=5.76-2.24-3.2=0.32g。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
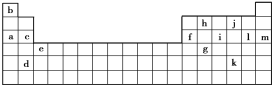
(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)以上13种元素中,____(填写字母)元素原子失去核外第一个电子需要的能量最多。i在周期表中的位置_________。
(3)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:原子核对核外电子的吸引力;形成稳定结构的倾向。
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1);
锂 | X | Y | |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7296 | 4570 | 1820 |
失去第三个电子 | 11799 | 6920 | 2750 |
失去第四个电子 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量______________。
②表中X可能为以上13种元素中的_____(填写字母)元素。用元素符号表示X和j形成化合物的化学式_____。
③Y是周期表中_____族元素。
【题目】元素处于基态时的气态原子获得一个电子成为-1价阴离子时所放出的能量叫做该元素的第一电子亲合能。-1价阴离子再获得一个电子的能量变化叫做第二电子亲合能。下表中给出了几种元素或离子的电子亲合能数据:
元素 | Li | Na | K | O |
| F |
电子亲合能kJ/mol |
|
|
| 141 |
|
|
下列说法不正确的是( )
A.电子亲合能越大,说明越容易得到电子
B.1mol基态的气态氟原子得到1mol电子成为氟离子时放出327.9kJ的能量
C.元素的第一电离能同主族的从上到下逐渐减小,同周期从左到右则逐渐增大
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量