题目内容
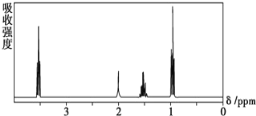
【题目】常温下,向20mL0.2mol·L-1H2C2O4溶液中滴加0.2mol·L-1NaOH溶液,有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水]。根据图示,下列说法不正确的是( )
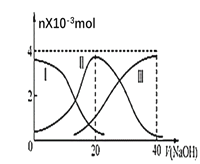
A.曲线Ⅱ代表的粒子是HC2O4-
B.当V(NaOH)=20mL时,溶液中离子浓度的大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-)
C.NaHC2O4溶液:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4)
D.向NaHC2O4溶液中逐渐加入CaCl2粉末并充分搅拌,溶液pH可能逐渐减小
【答案】B
【解析】
H2C2O4溶液与NaOH反应分两步进行,H2C2O4+NaOH= NaHC2O4+H2O、NaHC2O4+ NaOH= Na2C2O4+H2O,HC2O4-的物质的量先增大后减小,曲线Ⅱ代表HC2O4-、曲线Ⅰ代表H2C2O4、曲线Ⅲ代表C2O42-。
A. H2C2O4溶液与NaOH反应分两步进行,H2C2O4+NaOH= NaHC2O4+H2O、NaHC2O4+ NaOH= Na2C2O4+H2O,HC2O4-的物质的量先增大后减小,所以曲线Ⅱ代表的粒子是HC2O4-,故A正确;
B. 当V(NaOH)=20mL时,恰好反应生成NaHC2O4,根据图像可知c(C2O42-)> c(H2C2O4),说明HC2O4-电离大于水解,溶液中离子浓度的大小关系为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故B错误;
C.根据质子守恒, NaHC2O4溶液中c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4),故C正确;
D. 向NaHC2O4溶液中逐渐加入CaCl2粉末并充分搅拌,生成CaC2O4沉淀、氯化钠、氯化氢,所以溶液pH可能逐渐减小,故D正确;
选B。

 名校课堂系列答案
名校课堂系列答案【题目】写出下列反应的化学(离子)方程式
(1)HF不能装在玻璃瓶中,对应发生的化学方程式________
(2)NO2与一定量的O2混合通入水中,完全被水吸收的离子方程式________
(3)Pb的常见化合价是+2价和+4价,PbO2的某些化学性质与MnO2相似。写出实验室用PbO2与浓盐酸混合加热制氯气的化学方程式________
(4)SO2气体使溴水褪色的离子方程式________
(5)煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1.(溶液呈碱性)反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42- | SO32- | NO3- | NO2- | Cl= |
c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
写出NaClO2溶液脱硝过程中主要反应的离子方程式 ________。