题目内容
.在容积为2 L的密闭容器中,有反应:mA(g)+nB(g) pC(g)+qD(g),
pC(g)+qD(g),
经过5分钟达到平衡,此时,各物质的变化为:A减少了a mol·L-1, B的平均反应速率vB=a/15 mol·(L·min)-1,C增加了2a/3 mol·L-1,这时,若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
 pC(g)+qD(g),
pC(g)+qD(g),经过5分钟达到平衡,此时,各物质的变化为:A减少了a mol·L-1, B的平均反应速率vB=a/15 mol·(L·min)-1,C增加了2a/3 mol·L-1,这时,若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
| A.3∶1∶2∶2 | B.1∶3∶2∶2 | C.1∶3∶2∶1 | D.1∶1∶1∶1 |
A
mA(g)+nB(g) pC(g)+qD(g)
pC(g)+qD(g)
△c: a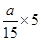 2a/3
2a/3
故m∶n∶p=3:1:2,又因为平衡时增加压强,A、C的百分含量均不变,说明平衡并没有移动,则两边气体的系数和相等,则m∶n∶p∶q=3∶1∶2∶2
 pC(g)+qD(g)
pC(g)+qD(g)△c: a
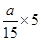 2a/3
2a/3故m∶n∶p=3:1:2,又因为平衡时增加压强,A、C的百分含量均不变,说明平衡并没有移动,则两边气体的系数和相等,则m∶n∶p∶q=3∶1∶2∶2

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
 2C(g) △H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是
2C(g) △H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是
 2HCN(g) + 6H2O(g)反应中,已知v (HCN) =" n" mol/(L·min),且v(O2) =" m" mol/(L·min),则m与n的关系正确的是
2HCN(g) + 6H2O(g)反应中,已知v (HCN) =" n" mol/(L·min),且v(O2) =" m" mol/(L·min),则m与n的关系正确的是



 .0.025 mol/(L·s) B.0.125mol/(L·s) C.0.05 mol/(L·s) D.0.1 mol/(L·s)
.0.025 mol/(L·s) B.0.125mol/(L·s) C.0.05 mol/(L·s) D.0.1 mol/(L·s)