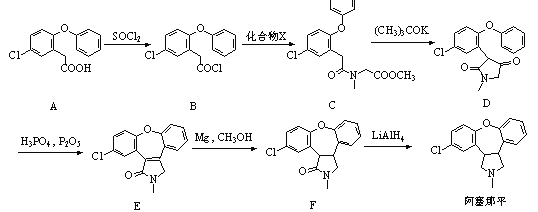
题目内容
【题目】如图所示,烧杯内盛有浓HNO3,在烧杯中放入用铜线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余。下列有关说法正确的是( ) .
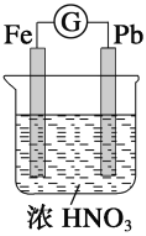
A. Fe比Pb活泼,始终作负极
B. Fe在浓HNO3中钝化,始终不会溶解
C. 电池停止工作时,烧杯中生成了Fe(NO3)3
D. 利用浓HNO3作电解质溶液不符合“绿色化学”思想
【答案】D
【解析】开始时,由于浓硝酸和铁发生钝化反应,阻止反应进行,故Fe是正极:![]() (还原反应);后来,硝酸浓度降低,由于铁的金属活泼性比铅强,故Fe是负极:
(还原反应);后来,硝酸浓度降低,由于铁的金属活泼性比铅强,故Fe是负极:![]() (氧化反应),亚铁离子在硝酸溶液中被氧化为三价铁离子,原电池停止工作时,三价铁离子又与铅发生反应生成亚铁离子和铅离子;由上述分析可知,A错误;由上述分析可知,B错误;由上述分析可知,最终为硝酸亚铁溶液,C错误;由发生的电极反应可知,有污染性气体产生,不符合绿色化学思想,D正确;正确选项D。
(氧化反应),亚铁离子在硝酸溶液中被氧化为三价铁离子,原电池停止工作时,三价铁离子又与铅发生反应生成亚铁离子和铅离子;由上述分析可知,A错误;由上述分析可知,B错误;由上述分析可知,最终为硝酸亚铁溶液,C错误;由发生的电极反应可知,有污染性气体产生,不符合绿色化学思想,D正确;正确选项D。

 优加精卷系列答案
优加精卷系列答案【题目】利用如图所示装置测定中和热的实验步骤如下:
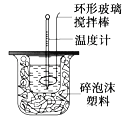
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
①为什么所用NaOH溶液要稍过量?__________________________________。
②倒入NaOH溶液的正确操作是__________(填字母)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
③现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________________。
④假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________(结果保留一位小数)。
⑤________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是______________________________________________________________________。