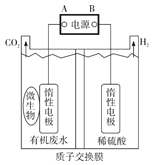
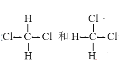题目内容
【题目】工业和生活中产生的废气![]() 、
、![]() 、
、![]() 对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为![]() ;1mol水蒸气变成液态水放热
;1mol水蒸气变成液态水放热![]() :
:![]()
![]() ,则
,则![]()
![]() ____________。
____________。
(2)汽车尾气中含有![]() 和
和![]() ,某研究小组利用反应:2CO(g)+2NO(g)
,某研究小组利用反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g)实现气体的无害化排放。T℃时,在恒容的密闭容器中通入一定量的
N2(g)+2CO2(g)实现气体的无害化排放。T℃时,在恒容的密闭容器中通入一定量的![]() 和
和![]() ,能自发进行上述反应,测得不同时间的
,能自发进行上述反应,测得不同时间的![]() 和
和![]() 的浓度如表:
的浓度如表:
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
①0到2s内用![]() 表示的化学反应速率为______,该温度下,反应的平衡常数K1=______。
表示的化学反应速率为______,该温度下,反应的平衡常数K1=______。
②若该反应在恒容绝热条件下进行,再次达到平衡后的平衡常数为K2,则K1______ K2(填“>”、“<”'或“=”)。
(3)一定条件下,通过下列反应可实现燃煤烟气中硫的回收2CO(g)+SO2(g)![]() S(s)+2CO2(g) △H<0
S(s)+2CO2(g) △H<0
若向![]() 恒容密闭容器中通入
恒容密闭容器中通入![]() 和
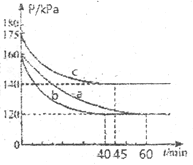
和![]() ,反应在不同条件下进行上述反应,反应体系总压强随时间变化如图所示,与实验a相比,span>b组、c组分别改变的实验条件可能是 ____________、____________。
,反应在不同条件下进行上述反应,反应体系总压强随时间变化如图所示,与实验a相比,span>b组、c组分别改变的实验条件可能是 ____________、____________。
(4)常温下,用![]() 溶液作
溶液作![]() 捕捉剂可以降低碳排放。若某次捕捉后得到pH=10的溶液,则溶液中
捕捉剂可以降低碳排放。若某次捕捉后得到pH=10的溶液,则溶液中![]() ____________。(常温下
____________。(常温下![]() 、
、![]() )
)
【答案】-1168kJ/mol 1.875×10-4mol/(L·s) 5000L/mol > 使用适当的催化剂 升高温度 2:1
【解析】
(1)根据图2写出热化学方程式,利用甲烷燃烧热写出热化学方程式,根据1mol水蒸气变成液态水放热44kJ,写出热化学方程式,再利用盖斯定律,由已知热化学方程式乘以适当的系数进行加减,得到目标热化学方程式;
(2)①根据图表,0~2s内,NO的浓度变化为△c(NO)=(1-0.25)×10-3=0.75×10-3mol/L,反应经历的时间为△t=2s,则NO的化学反应平均速率为v(NO)=![]() 计算,根据速率之比等于化学计量数之比计算N2的化学反应平均速率,该反应的化学平衡常数为K=
计算,根据速率之比等于化学计量数之比计算N2的化学反应平均速率,该反应的化学平衡常数为K=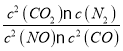 ,根据反应方程式计算各组分的平衡浓度并代入;
,根据反应方程式计算各组分的平衡浓度并代入;
②反应为2CO+2NO![]() N2+2CO2,为气体数减少的反应,熵变△S<0,由于反应能自发进行,则焓变△H<0,反应为放热反应,若该反应在绝热恒容条件下进行,随着反应的进行,容器内温度升高,升温使化学平衡向逆反应方向移动来分析K1、K2的大小;
N2+2CO2,为气体数减少的反应,熵变△S<0,由于反应能自发进行,则焓变△H<0,反应为放热反应,若该反应在绝热恒容条件下进行,随着反应的进行,容器内温度升高,升温使化学平衡向逆反应方向移动来分析K1、K2的大小;
(3)b与a比较,反应速率快,平衡总压强不变,说明平衡不移动;c与a比较,平衡时总压强大,根据物质的量与气体压强的关系,通过温度变化分析判断;
(4)由题意pH=10,可计算c(OH-)=10-4mol/L,由CO32-+H2O![]() HCO3-+OH-可得:Kb=
HCO3-+OH-可得:Kb=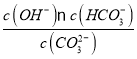 =
=![]() 据此进行计算。
据此进行计算。
(1)根据图2,旧键断裂吸收能量为:945+498=1443kJ/mol,放出能量为:2×630=1260kJ/mol,则热化学方程式为2NO(g)=O2(g)+N2(g) △H=-1260kJ/mol+1443kJ/mol=183kJ/mol ①;
甲烷燃烧热为890kJ/mol,可写出热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol ②;
H2O(g)=H2O(l) △H=-44kJ/mol③;
由盖斯定律可知②+①×2-③×2,可得目标热化学方程式,则△H=-810.1kJ/mol+183/mol×2-(44kJ/mol)×2=-1168kJ/mol;
(2)①根据图表,0~2s内,NO的浓度变化为△c(NO)=(1-0.25)×10-3 mol/L =0.75×10-3mol/L,反应经历的时间为△t=2s,则NO的化学反应平均速率为v(NO)=![]() =3.75×10-4mol/(L·s),根据速率之比等于化学计量数之比,则0~2s内用N2表示的化学反应速率为v(N2)=
=3.75×10-4mol/(L·s),根据速率之比等于化学计量数之比,则0~2s内用N2表示的化学反应速率为v(N2)=![]() v(NO)= 1.875×10-4mol/(Ls);据表中数据,平衡时,c(NO)=0.1×10-3mol/(Ls),c(CO)=2.70×10-3mol/(Ls),根据反应方程式:2CO+2NON2+2CO2,则平衡时,c(N2)=0.45×10-3mol/L,c(CO2)=0.9×10-3mol/L,则平衡常数为K=
v(NO)= 1.875×10-4mol/(Ls);据表中数据,平衡时,c(NO)=0.1×10-3mol/(Ls),c(CO)=2.70×10-3mol/(Ls),根据反应方程式:2CO+2NON2+2CO2,则平衡时,c(N2)=0.45×10-3mol/L,c(CO2)=0.9×10-3mol/L,则平衡常数为K=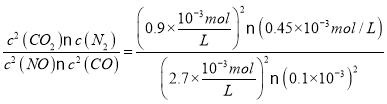 =5000L/mol;
=5000L/mol;
②反应为2CO+2NON2+2CO2,为气体数减少的反应,熵变△S<0,由于反应能自发进行,则焓变△H<0,反应为放热反应,若该反应在绝热恒容条件下进行,随着反应的进行,容器内温度升高,升温使化学平衡向逆反应方向移动,则正向进行的趋势不断减小,平衡常数减小,因此K1>K2;
(3)b与a比较,反应速率快,达到平衡所需的时间短,但平衡总压强不变,说明平衡时气体的物质的量与条件a比较,物质的量不变,平衡不发生移动,则改变的条件为使用合适的催化剂;c与a比较,反应速率快,达到平衡所需的时间短,而且平衡时总压强大,由于该反应的正反应是气体体积减小的放热反应,平衡逆向移动,反应速率快,则改变的条件为升高温度;
(4)根据题意pH=10,可计算c(OH-)=10-4mol/L,由于CO32-+H2O![]() HCO3-
HCO3-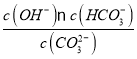 =
=![]() ,
, =
= =2:1,则c(CO32-):c(HCO3-)=2:1。
=2:1,则c(CO32-):c(HCO3-)=2:1。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案