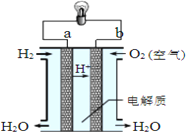
题目内容
【题目】恒温恒容条件,在密闭容器中等物质的量通入CO2和H2,反应CO2+3H2CH3OH+H2O(g)。下列描述能说明已经达到平衡状态的是( )
A.容器内CO2的体积分数不再变化
B.当CO2和H2转化率的比值不再变化
C.单位时间内断裂3NA个O-H键,同时断裂3NA个H-H键
D.容器内混合气体的平均相对分子质量为34.5,且保持不变
【答案】C
【解析】
甲醇的沸点比水低,水为气态,则甲醇必为气态,设CO2和H2起始物质的量为3mol,到达平衡时二氧化碳转换的物质的量为x,则: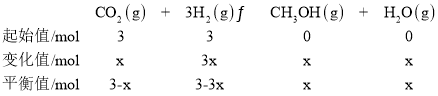 ,据此分析解答。
,据此分析解答。
A.CO2的体积分数=![]() =
=![]() ,即无论反应是否平衡,容器内CO2的体积分数均不变化,故容器内CO2的体积分数不再变化不能说明反应已平衡,A错误;
,即无论反应是否平衡,容器内CO2的体积分数均不变化,故容器内CO2的体积分数不再变化不能说明反应已平衡,A错误;
B.CO2和H2转化率的比值=![]() =
=![]() ,即无论反应是否平衡,CO2和H2转化率的比值均不变,故当CO2和H2转化率的比值不再变化,不能说明已平衡,B错误;
,即无论反应是否平衡,CO2和H2转化率的比值均不变,故当CO2和H2转化率的比值不再变化,不能说明已平衡,B错误;
C.单位时间内断裂3NA个O-H键,同时断裂3NA个H-H键,则v逆(H2)=v正(H2),说明反应已平衡,C正确;
D.设平均相对分子质量为M,还没开始反应时,M=![]() =23,假设反应彻底向右进行,n(CO2):n(H2)=3:3>1:3,氢气反应完,3-3x=0,x=1,M=
=23,假设反应彻底向右进行,n(CO2):n(H2)=3:3>1:3,氢气反应完,3-3x=0,x=1,M=![]() =34.5,因为该反应为可逆反应,23<M<34.5,混合气体的平均相对分子质量不可能为34.5,D错误。
=34.5,因为该反应为可逆反应,23<M<34.5,混合气体的平均相对分子质量不可能为34.5,D错误。
答案选C。

【题目】工业和生活中产生的废气![]() 、
、![]() 、
、![]() 对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为![]() ;1mol水蒸气变成液态水放热
;1mol水蒸气变成液态水放热![]() :
:![]()
![]() ,则
,则![]()
![]() ____________。
____________。
(2)汽车尾气中含有![]() 和
和![]() ,某研究小组利用反应:2CO(g)+2NO(g)
,某研究小组利用反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g)实现气体的无害化排放。T℃时,在恒容的密闭容器中通入一定量的
N2(g)+2CO2(g)实现气体的无害化排放。T℃时,在恒容的密闭容器中通入一定量的![]() 和
和![]() ,能自发进行上述反应,测得不同时间的
,能自发进行上述反应,测得不同时间的![]() 和
和![]() 的浓度如表:
的浓度如表:
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
①0到2s内用![]() 表示的化学反应速率为______,该温度下,反应的平衡常数K1=______。
表示的化学反应速率为______,该温度下,反应的平衡常数K1=______。
②若该反应在恒容绝热条件下进行,再次达到平衡后的平衡常数为K2,则K1______ K2(填“>”、“<”'或“=”)。
(3)一定条件下,通过下列反应可实现燃煤烟气中硫的回收2CO(g)+SO2(g)![]() S(s)+2CO2(g) △H<0
S(s)+2CO2(g) △H<0
若向![]() 恒容密闭容器中通入
恒容密闭容器中通入![]() 和
和![]() ,反应在不同条件下进行上述反应,反应体系总压强随时间变化如图所示,与实验a相比,span>b组、c组分别改变的实验条件可能是 ____________、____________。
,反应在不同条件下进行上述反应,反应体系总压强随时间变化如图所示,与实验a相比,span>b组、c组分别改变的实验条件可能是 ____________、____________。

(4)常温下,用![]() 溶液作
溶液作![]() 捕捉剂可以降低碳排放。若某次捕捉后得到pH=10的溶液,则溶液中
捕捉剂可以降低碳排放。若某次捕捉后得到pH=10的溶液,则溶液中![]() ____________。(常温下
____________。(常温下![]() 、
、![]() )
)