题目内容
【题目】![]() 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:![]() 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为![]() 。
。
回答下列问题:
(1)![]() 发生裂变反应:
发生裂变反应:![]() ,净产生的中子(
,净产生的中子(![]() )数为________。基态
)数为________。基态![]() 原子的外围电子排布式为
原子的外围电子排布式为![]() ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
A ![]() B
B ![]() C
C ![]() D
D ![]()
(2)![]() 和
和![]() 中,沸点较高的为________,与
中,沸点较高的为________,与![]() 形成的配离子稳定性较高的为________。
形成的配离子稳定性较高的为________。
(3)![]() 中存在大
中存在大![]() 键,形成该大
键,形成该大![]() 键的电子数为________。
键的电子数为________。
(4)某种铀氮化物的晶体结构与![]() 相同。
相同。![]() 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
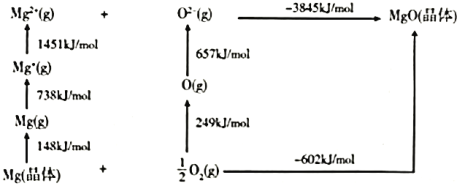
①![]() 晶格能为________
晶格能为________![]() 。
。
②![]() 的第二电离能大于
的第二电离能大于![]() 的第二电离能,是由于
的第二电离能,是由于![]() 的半径较
的半径较![]() 小、
小、![]() 的核电荷更高以及_______。
的核电荷更高以及_______。
(5)另一种铀氮化物的晶胞如下图所示,![]() “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
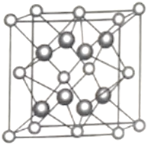
①铀元素的化合价为________,![]() “原子”的配位数为________。
“原子”的配位数为________。
②已知晶胞参数为![]() ,则晶体的密度为________
,则晶体的密度为________![]() (列出计算式)。
(列出计算式)。
【答案】![]() B
B ![]()
![]() 6 3845
6 3845 ![]() 为
为![]() 相对稳定结构,破坏需要额外提供能量
相对稳定结构,破坏需要额外提供能量 ![]() 8
8 
【解析】
根据裂变反应:![]() 中净产生的中子(
中净产生的中子(![]() )数和
)数和![]() 的物质的量判断;核外电子排布轨道处于半充满和全充满时相对稳定;根据电离能的递变性和变化规律判断;根据晶胞结构分析晶体的化学式并进行相关计算。
的物质的量判断;核外电子排布轨道处于半充满和全充满时相对稳定;根据电离能的递变性和变化规律判断;根据晶胞结构分析晶体的化学式并进行相关计算。
(1)![]() 的物质的量为1mol,根据裂变反应:
的物质的量为1mol,根据裂变反应:![]() ,可知净产生的中子(
,可知净产生的中子(![]() )的物质的量为2mol,数目为2NA;基态U原子的外围电子排布式为5f36d17s2,
)的物质的量为2mol,数目为2NA;基态U原子的外围电子排布式为5f36d17s2,![]() 、
、![]() 和
和![]() 均为其基态原子的激发态,
均为其基态原子的激发态,![]() 为U+,由第二电离明显高于第一电离可知,
为U+,由第二电离明显高于第一电离可知,![]() 再失去1个电子所需要的能量最高,故答案为B;
再失去1个电子所需要的能量最高,故答案为B;
(2)NH3常温下为气态,而H2O常温下为液态,则沸点较高的为H2O;NH3结合质子的能力强于H2O,则NH3与Cu2+形成的配离子稳定性强于H2O与Cu2+形成的配离子稳定性;
(3)CO32-中存在大π键,C原子孤对电子数为![]() =0,则其路易斯结构式为
=0,则其路易斯结构式为 ,形成的大π键为
,形成的大π键为![]() ,该大π键的电子数为6;
,该大π键的电子数为6;
(4)①MgO的晶格能为Mg2+(g)和O2-(g)生成MgO(s)放出的能量,则MgO的晶格能为3845kJmol-1;
②
(5)另一种铀氮化物的晶胞是U“原子”作面心立方最密堆积,其中含有U的原子数目为8×![]() +6×
+6×![]() =4,N原子数为8,其化学式为UN2;
=4,N原子数为8,其化学式为UN2;
①晶胞化学式为UN2,其中N为-3价,则铀元素的化合价为+6价;晶胞中顶点U原子最靠近的N原子数是1,顶点U为8个晶胞共用,则U原子的配位数为8;
②已知晶胞参数为anm,晶胞的体积为(a×10-7cm)3,晶胞的质量为![]() g,则晶体的密度为
g,则晶体的密度为![]() =
= g/cm3。
g/cm3。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案