题目内容
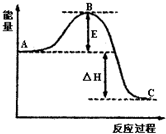 H2O2是重要的氧化剂,它的水溶液常用来消毒、杀菌、漂白等.请回答下列有关问题.
H2O2是重要的氧化剂,它的水溶液常用来消毒、杀菌、漂白等.请回答下列有关问题.(1)2H2O2(l)═2H2O(l)+O2(g)反应过程中的 能量变化如图所示.已知1mol H2O2(l)分解时的△H=-98.23kJ?mol-1
①H2O2的分解反应常温下能自发进行,其原因是
(2)某化学兴趣小组用酸性KMnO4标准溶液滴定H2O2溶液样品,测定H2O2溶液中H2O2的含量.其反应的离子方程式为:5H2O2+2MnO4-+6H+═2Mn2++5O2↑+8H2O
①酸性KMnO4溶液应放在
②用KMnO4溶液滴定H2O2样品,终点时溶液颜色变化为
考点:反应热和焓变,探究物质的组成或测量物质的含量
专题:实验探究和数据处理题,化学反应中的能量变化
分析:(1)①反应自发进行的判断依据是△H-T△S<0;催化剂能降低反应的活化能,但反应热不变;根据反应热与物质的物质的量成正比;
(2)酸性KMnO4溶液具有强化性,能腐蚀橡皮,要用酸式滴定管量取;滴定终点的现象是:滴入最后1滴高锰酸钾溶液,溶液呈红色,且半分钟内不褪色;
(2)酸性KMnO4溶液具有强化性,能腐蚀橡皮,要用酸式滴定管量取;滴定终点的现象是:滴入最后1滴高锰酸钾溶液,溶液呈红色,且半分钟内不褪色;
解答:
解:(1)①2H2O2(l)═2H2O(l)+O2(g)△H<0,反应有气体生成,△S>0,则△H-T△S<0,故反应能在常温下自发进行;催化剂能降低反应的活化能,但反应热不变,所以图中B点降低;已知1mol H2O2(l)分解时的△H=-98.23kJ?mol-1,2H2O2(l)═2H2O(l)+O2(g)反应过程中的 能量变化如图所示,反应热与物质的物质的量成正比,所以图中△H=-98.23kJ?mol-1×2=-196.46kJ?mol-1;
故答案为:△H<0,反应有气体生成,△S>0,△H-T△S<0,故反应能在常温下自发进行;降低;-196.46kJ?mol-1;
(2)酸性KMnO4溶液具有强化性,能腐蚀橡皮,所以要用酸式滴定管盛放,滴定终点的现象是:滴入最后1滴高锰酸钾溶液,溶液呈红色,且半分钟内不褪色,
故答案为:酸式,溶液由无色变为浅紫色,且半分钟内不褪色;
故答案为:△H<0,反应有气体生成,△S>0,△H-T△S<0,故反应能在常温下自发进行;降低;-196.46kJ?mol-1;
(2)酸性KMnO4溶液具有强化性,能腐蚀橡皮,所以要用酸式滴定管盛放,滴定终点的现象是:滴入最后1滴高锰酸钾溶液,溶液呈红色,且半分钟内不褪色,
故答案为:酸式,溶液由无色变为浅紫色,且半分钟内不褪色;
点评:本题主要考查了反应的自发性、活化能、反应热的计算和氧化还原滴定,难度不大,注意知识的运用.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
化学与科技、社会、生产密切结合,下列有关说法正确的是( )
| A、“纯净水”清洁、纯净,长期饮用有益健康 |
| B、维生素C不宜与含硫酸亚铁的补血剂同服 |
| C、在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| D、味觉上具有酸味的食物即酸性食物,长期食用会导致血液偏酸性,引起缺钙 |
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、46g有机物C2H6O中含有的H-O键的数目为NA |
| B、常温下,2L 1mol?L-1的乙酸溶液中,所含分子总数小于2NA |
| C、标准状况下,5.6L NO和5.6L O2组成的混合气体中所含原子数为NA |
| D、18g D2O含有的电子总数为10NA |
某研究小组开展课外研究发现,将适量Zn与一定浓度氯化铁溶液反应,开始可以观察到大量气泡产生.反应后期,溶液的pH升高到6左右,金属表面出现黑色粉末,溶液变成浅绿色.试管底部出现灰绿色悬浮物.收集少量黑色粉末与稀硫酸作用有气泡产生.则下列反应没有发生的是( )
| A、FeCl3+3H2O═Fe(OH)3↓+3HCl |
| B、Zn+2HCl═ZnCl2+H2↑ |
| C、3Zn+2FeCl3═3ZnCl2+2Fe |
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |