题目内容
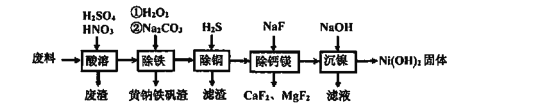
【题目】Co(H2PO2)2广泛用于化学镀钴,以金属Co和NaH2PO2为原料,采用四室电渗析槽电解法制备,原理如图。下列叙述正确的是

A. b为阳离子交换膜
B. 通电后原料室的H2PO2向产品室迁移,阴极区溶液pH增大
C. 石墨电极反应为4OH4e![]() O2↑+2H2O
O2↑+2H2O
D. 当产生1 mol Co(H2PO2)2时,产生标准状况下气体11.2 L
【答案】B
【解析】
由金属Co生成Co(H2PO2)2可知,Co电极为阳极,Co放电生成Co2+,Co2+离子阳离子交换膜进入产品室,原料室的H2PO3-穿过阴膜扩散至产品室,二者反应生成Co(H2PO2)2;石墨电极为阴极,阴极上水电离出的H+放电,使阴极区OH—浓度增大,原料室中Na+通过阳离子交换膜进入阴极区,使得阴极区氢氧化钠溶液浓度增大。
A项、原料室的H2PO3-穿过阴膜扩散至产品室,b为阴离子交换膜,故A错误;
B项、通电后原料室的H2PO2向产品室迁移,阴极区,阴极上水电离出的H+放电,使阴极区OH—浓度增大,溶液pH增大,故B正确;
C项、石墨电极为阴极,阴极上水电离出的H+放电,电极反应式为2H2O+2e=H2↑+2 OH,故C错误;
D项、当产生1 mol Co(H2PO2)2时,阳极上1 mol Co放电,失去2mol电子,则阴极上水放电有1 mol H2生成,标准状况下H2体积为22.4L,故D错误。
故选B。

【题目】实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表:
化合物 | 相对分子质量 | 密度 /g·cm-3 | 沸点 /℃ | 溶解度 /100g水 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |

操作如下:
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3-4滴浓硫酸,投入沸石。安装分水器![]() 作用:实验过程中不断分离除去反应生成的水
作用:实验过程中不断分离除去反应生成的水![]() 、温度计及回流冷凝管。
、温度计及回流冷凝管。
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10%Na2CO3溶液洗涤,再水洗,最后转移至锥形瓶,干燥。
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得到15.1g乙酸正丁酯。
请回答有关问题:
(1)冷水应该从冷凝管___(填“a”或“b”)端管口通入;
(2)反应中浓硫酸的作用是___;
(3)步骤②中用10%Na2CO3溶液洗涤有机层,该操作的目的是___;
(4)进行分液操作时,使用的漏斗是___(填选项);

(5)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏__(填“高”或“低”),原因__;
(6)该实验过程中,生成乙酸正丁酯的产率是___。