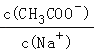题目内容
【题目】NaFeO4是一种高效多功能水处理剂。制备方法之一如下:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。下列说法正确的是
A. 氧化产物是Na2FeO4
B. 1molFeSO4还原3mol Na2O2
C. 转移0.5mo1电子时生成16.6g Na2FeO4
D. 氧化产物与还原产物的物质的量之比为3:2
【答案】C
【解析】
该反应中Fe元素化合价由+2价变为+6价、O元素化合价由-1价变为0价、-2价,所以硫酸亚铁是还原剂、过氧化钠既是氧化剂又是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物。A、化合价升高的元素有+2价的铁和-1价的氧元素,氧化产物是Na2FeO4和氧气,故A错误;B、反应中化合价升高的元素有Fe,由+2价→+6价,化合价升高的元素还有O元素,由-1价→0价,2molFeSO4发生反应时,共有2mol×4+1mol×2=10mol电子转移,6molNa2O2有5mol作氧化剂、1molNa2O2作还原剂,其中2molFeSO4还原4mol Na2O2,即1molFeSO4还原2mol Na2O2,故B错误;C、由方程式转移10mol电子生成2molNa2FeO4,转移0.5mo1电子时生成![]() ×2×166g·mol-1=16.6g Na2FeO4,故C正确;D、每2FeSO4和6Na2O2发生反应,氧化产物2molNa2FeO4和1molO2,还原产物2molNa2FeO4和2molNa2O,氧化产物与还原产物的物质的量之比为3:4,故D错误;故选C。
×2×166g·mol-1=16.6g Na2FeO4,故C正确;D、每2FeSO4和6Na2O2发生反应,氧化产物2molNa2FeO4和1molO2,还原产物2molNa2FeO4和2molNa2O,氧化产物与还原产物的物质的量之比为3:4,故D错误;故选C。

 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】室温下,将0.05molCH3COONa固体溶于水配成100mL溶液,向溶液中加入下列物质充分混合后,有关结论不正确的是( )
加入的物质 | 结论 | |
A | 0.05molCH3COONa固体 |
|
B | 0.05molNaHSO4固体 | c(CH3COO﹣)+c(CH3COOH)=c(Na+)﹣c(SO42﹣) |
C | 0.05molNH4Cl固体 | 水电离程度增大 |
D | 50mLH2O | 由水电离出的c(H+)·c(OH﹣)减小 |
A. AB. BC. CD. D
【题目】实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表:
化合物 | 相对分子质量 | 密度 /g·cm-3 | 沸点 /℃ | 溶解度 /100g水 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
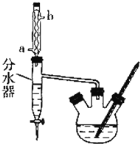
操作如下:
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3-4滴浓硫酸,投入沸石。安装分水器![]() 作用:实验过程中不断分离除去反应生成的水
作用:实验过程中不断分离除去反应生成的水![]() 、温度计及回流冷凝管。
、温度计及回流冷凝管。
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10%Na2CO3溶液洗涤,再水洗,最后转移至锥形瓶,干燥。
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得到15.1g乙酸正丁酯。
请回答有关问题:
(1)冷水应该从冷凝管___(填“a”或“b”)端管口通入;
(2)反应中浓硫酸的作用是___;
(3)步骤②中用10%Na2CO3溶液洗涤有机层,该操作的目的是___;
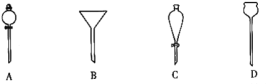
(4)进行分液操作时,使用的漏斗是___(填选项);
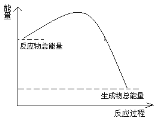
(5)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏__(填“高”或“低”),原因__;
(6)该实验过程中,生成乙酸正丁酯的产率是___。